
共
价
键
其
二
杂化轨道理论
我们知道,如果要形成共价键需要有未成对的电子。碳原子的价电子排布为2s22p2,即存在两个未成对的2p电子。由此看来,碳原子应与氢原子以1:2结合,生成CH。若需要以1:4结合,则需要1个2s轨道的电子受外界影响跃迁到2p空轨道,但此时2s12p3的电子排布也没办法形成正四面体结构。
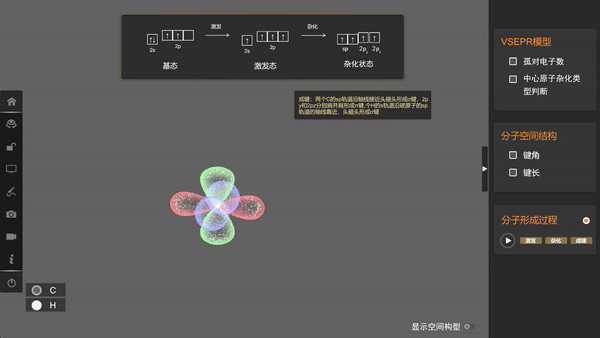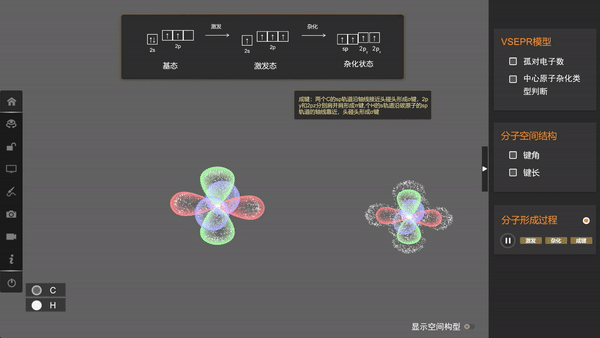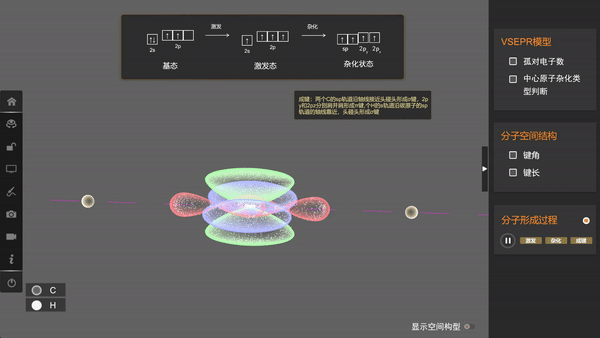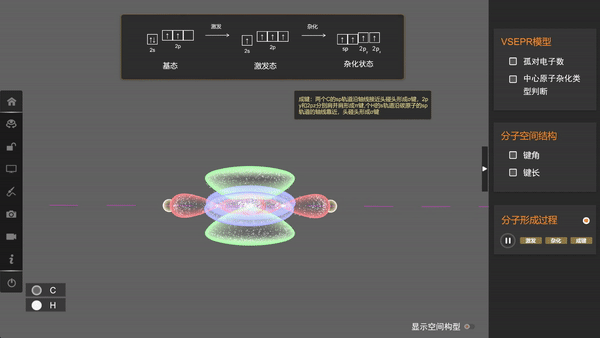
为了解释这个问题,美国化学家鲍林提出了杂化轨道理论。他认为,在周围原子的影响下,碳原子中原有的2s轨道和三个2p轨道会进一步线性组合成新的、能量相等的原子轨道。这种在一个原子中不同原子轨道的线性组合,称为原子轨道的杂化。杂化后的原子轨道称为杂化轨道。接下来我们借助矩道化学3D融合创新实验室软件一起来观察原子的杂化。

图8:CH4
可以看出,在杂化时,轨道的数目不变,轨道在空间中的分布方向和分布情况会发生改变,在与周围其他原子的原子轨道成键时重叠程度更大,形成的共价键更牢固。像甲烷中的碳原子这样1个s轨道和3个p轨道的杂化称为sp3杂化,所生成的四个杂化轨道称为sp3杂化轨道。
由于这四个轨道能量相同,根据洪特规则,价电子会以自旋相同的状态占据各个轨道。因此,当碳与氢原子成键时,每个杂化轨道分别与一个氢原子的1s轨道重叠生成一个共价键,这样所形成的四个共价键是等同的,从而使甲烷具有正四面体结构。

S轨道与p轨道的杂化除了sp3杂化外,还有其他情况,例如,一个s轨道和两个p轨道杂化可形成三个sp2杂化轨道,一个s轨道和一个p轨道杂化可形成两个sp杂化轨道。


形成乙炔分子时,碳原子采用sp杂化,两个sp杂化轨道和两个未参与杂化的p轨道各有一个未成对电子,两个碳原子各以一个sp杂化轨道重叠形成一个σ键,同时p轨道分别重叠形成两个π键;每个碳原子都以另一个sp杂化轨道与1个氢原子的1s轨道重叠形成一个σ键。
上海矩道网络科技有限公司(简称“矩道科技”),是一家以“让教育多一个维度”为愿景的高新技术企业。公司致力于3D互动教学系统、虚拟现实VR教学系统的研发、应用与市场拓展。截止2021年底,已有上千所学校将矩道实验室应用于教学,我们希望:每个学生都拥有属于自己专业而安全的VR/3D虚拟仿真实验室。
END


















