矩道化学虚拟实验室软件,将常规教学中难以观察的原子的空间微观可视化,抽象晦涩的化学概念原理模型化、过程化。
在上一篇文章中我们提到多原子分子的结构可以形成正多边形或多面体的形状,但实际分子中并没有成为正多边形或多面体的形状,其原因有如下几点:
(1)A与X的成键可能是单键,也可能是双键或三键,我们将双键或三键按照一个键区考虑。
但由于双键的4个电子或者三键中的6个电子占据的空间大于单键中的2个电子,所以排斥力大小可以定性为:
t-t > t-d > d-d > d-s > s-s(t-三键,d-双键,s-单键)
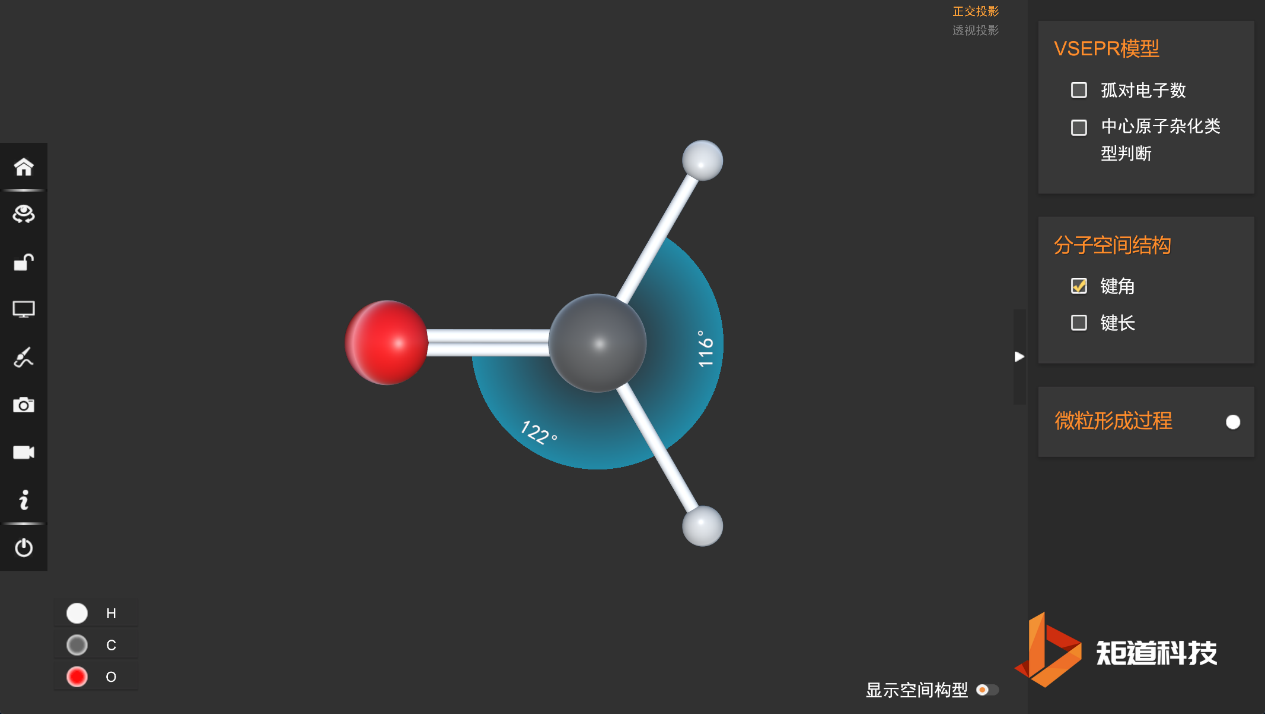
这样,多重键的存在会影响分子结构,甲醛HCHO中单双键之间的夹角为122°,单键之间夹角为116°。
如下图,借助矩道化学融合创新实验室软件观察HCHO的分子结构:
(2)成键电子对和孤对电子对的分布并不相同,成键电子会受成键原子核的束缚,比较集中在键轴附近,相对较“瘦”;而孤对电子就没这个限制,相对比较“肥大”,对相邻的电子对排斥作用更大。因此,价电子对之间的排斥力大小顺序为:
lp-lp ≫ lp-bp > bp-bp(lp-孤对电子对,bp-成键电子对)
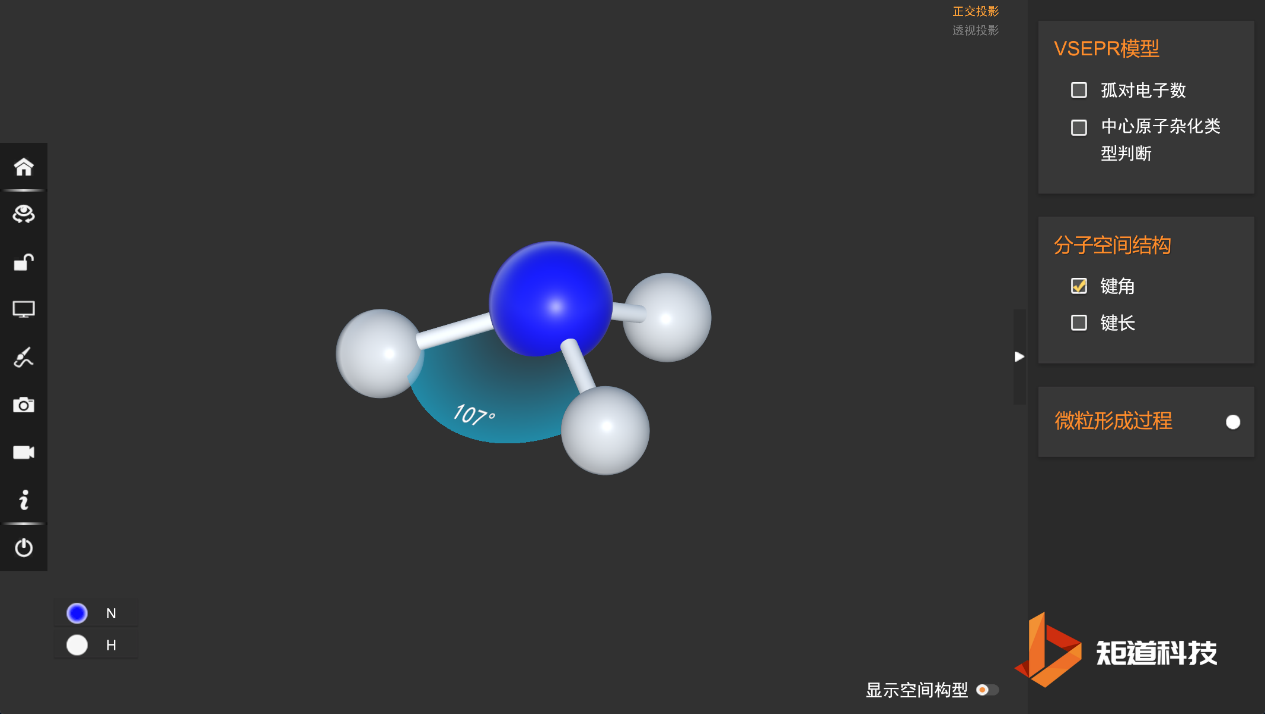
因此,虽然H₂O和CH₄的价电子对都是四面体构型,但是H-O-H的夹角只有105°,H-C-H的夹角为108°28’。


(3)配位原子的电负性越强,对于价电子的吸引力越大,价电子离中心原子越远,占据空间角度越小,因此会有
χw-χw > χw-χs > χs-χs(χ代表配位原子的电负性,下标w为弱,s为强)
因此虽然在氨气分子中H-N-H的夹角为107°,但是三氟化氮NF₃中的键角仅有102.5°。
END
















