矩道化学虚拟现实课堂,基于一线教学实践,以学科素养为指导,以开放性、探究性、学科性为主要目标,助力基于VR情境、问题导向为基础的科学探究活动,促进化学学科关键素养——理解与辨析、分析与推测、探究与创新、归纳与论证的养成,推进个性化学习,引领学生高阶思维发展。
之前的文章中,我们已经详细介绍了价层电子对互斥模型的要点,接下来我们尝试用VSEPR模型来预测和解释一些分子的空间结构。
01
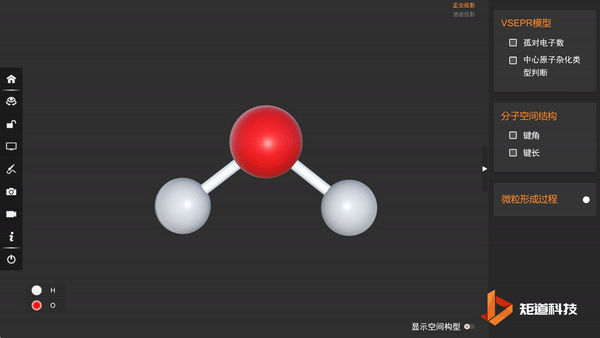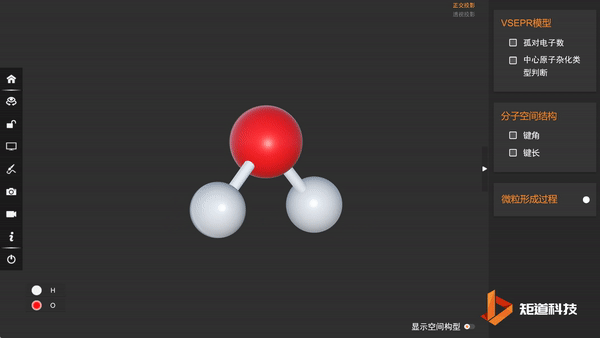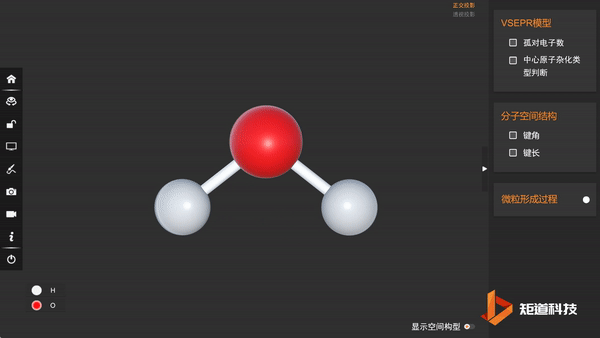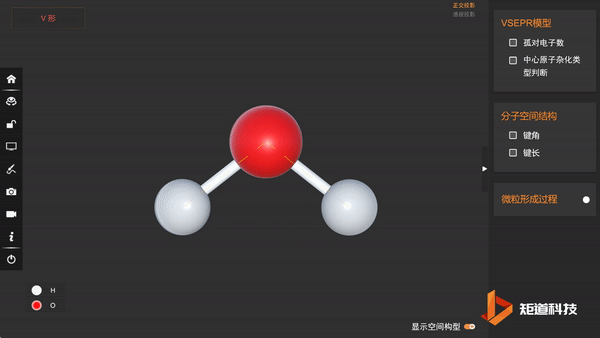
预测H₂O的空间结构
(1)H₂O的孤对电子数为2,属于AX₂E₂形,价电子对数为4
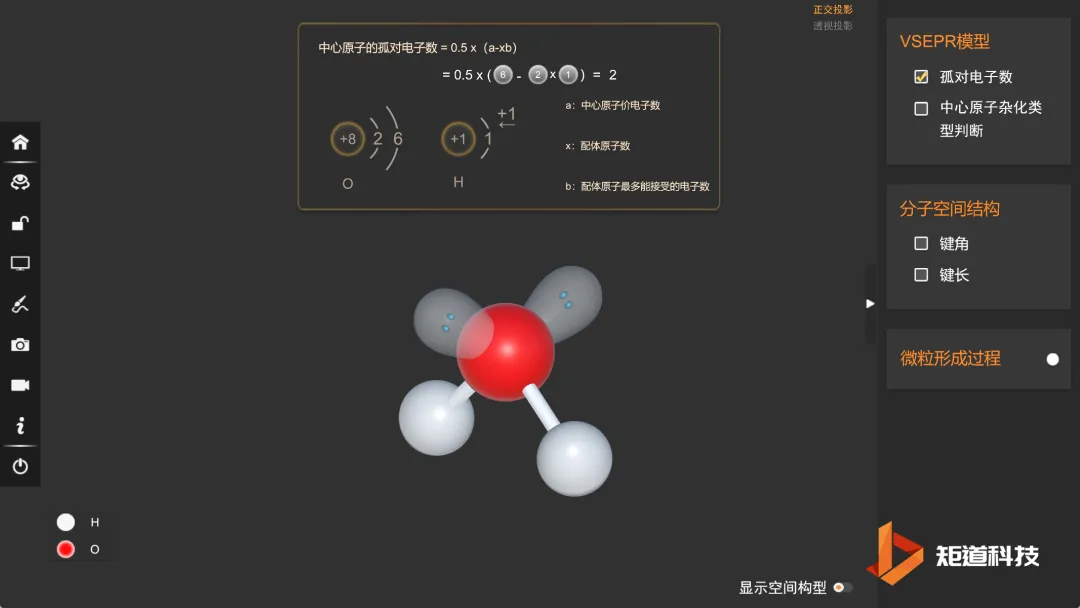
(2)VSEPR模型为正四面体形,价层电子对间夹角均为109°28′
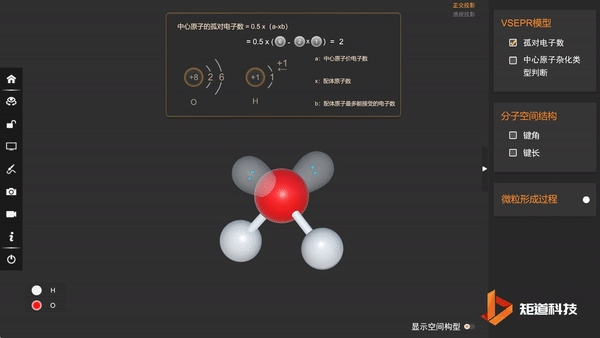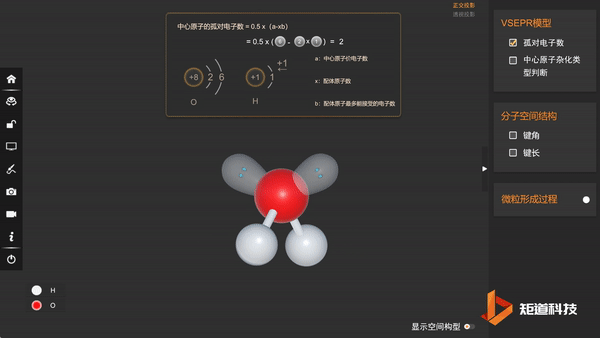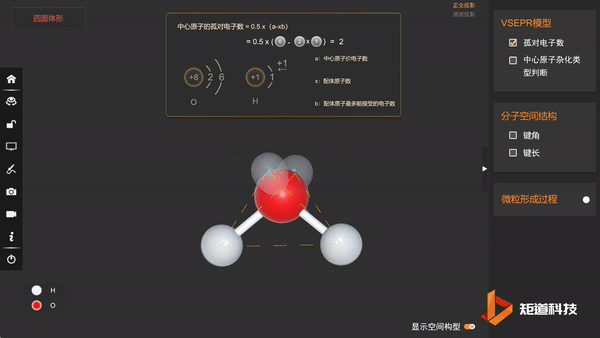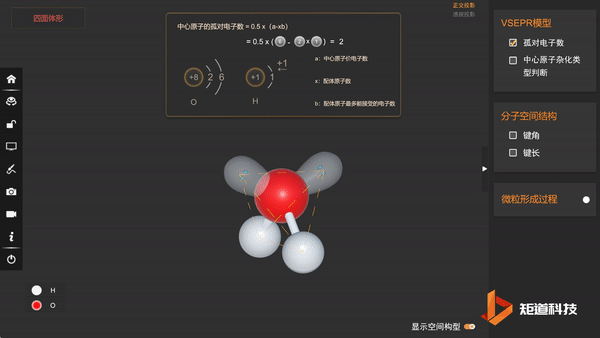
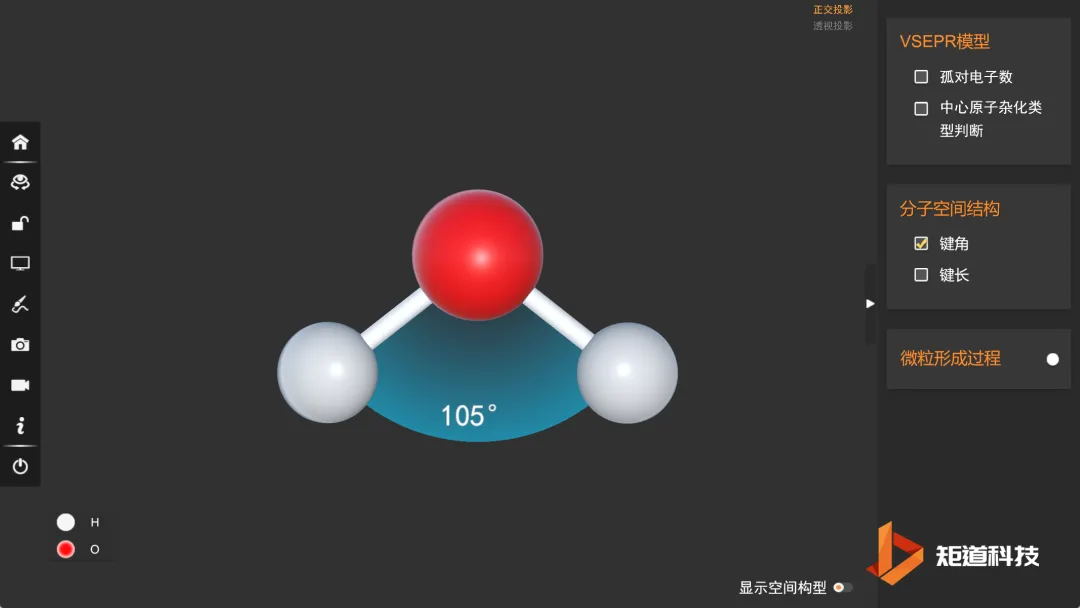
(3)分子的空间结构为V形
(4)根据斥力顺序,有:
∠l - O - l>∠l - O - H>∠H - O - H
因此水分子的空间结构为V形,键角小于109°28′。
02
预测甲醛的空间结构
(1)HCHO的孤对电子数为0,属于AX₃E₀形,价电子对数为3
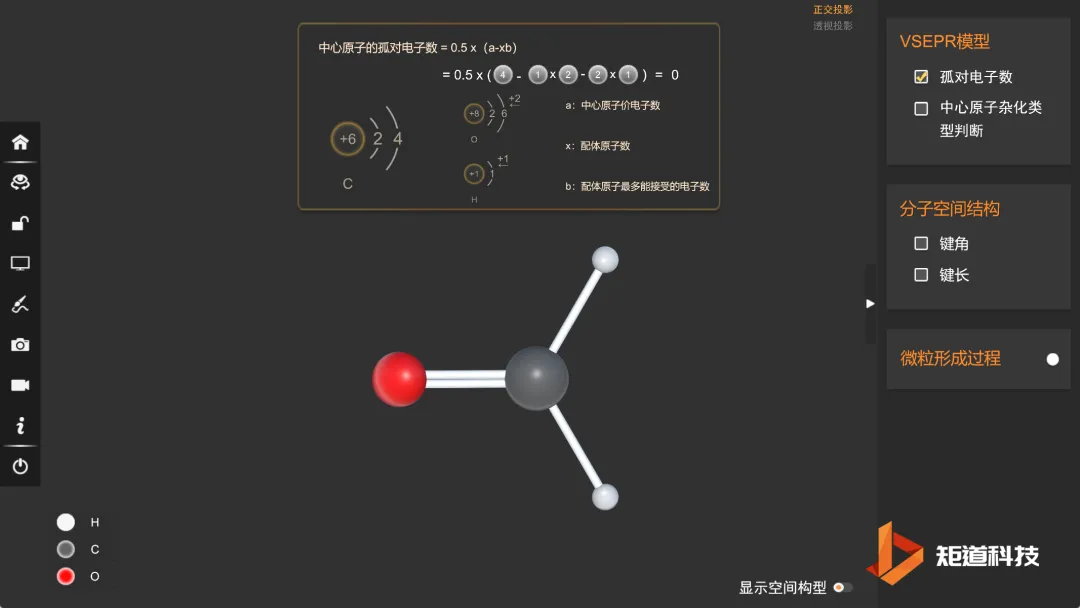
(2)VSEPR模型为正三角形,价层电子对间夹角均为120°
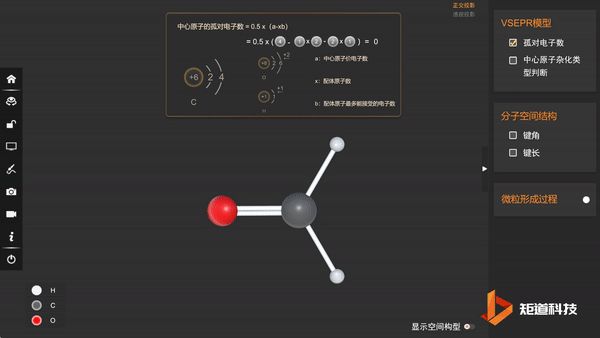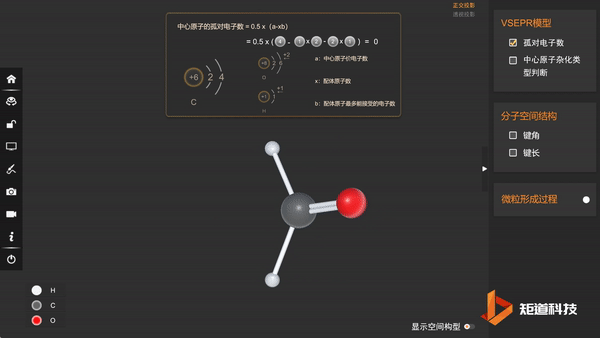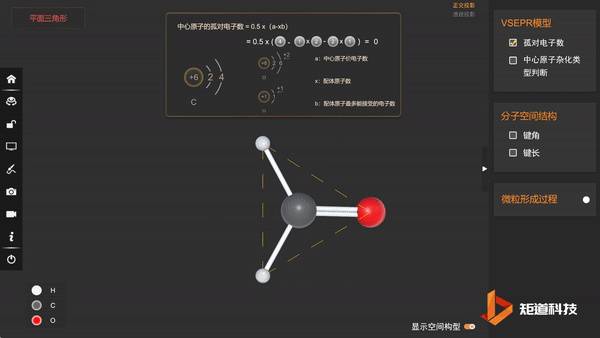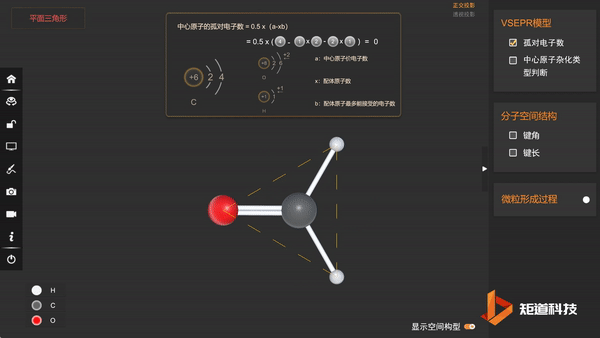
(3)分子的空间构型为三角形
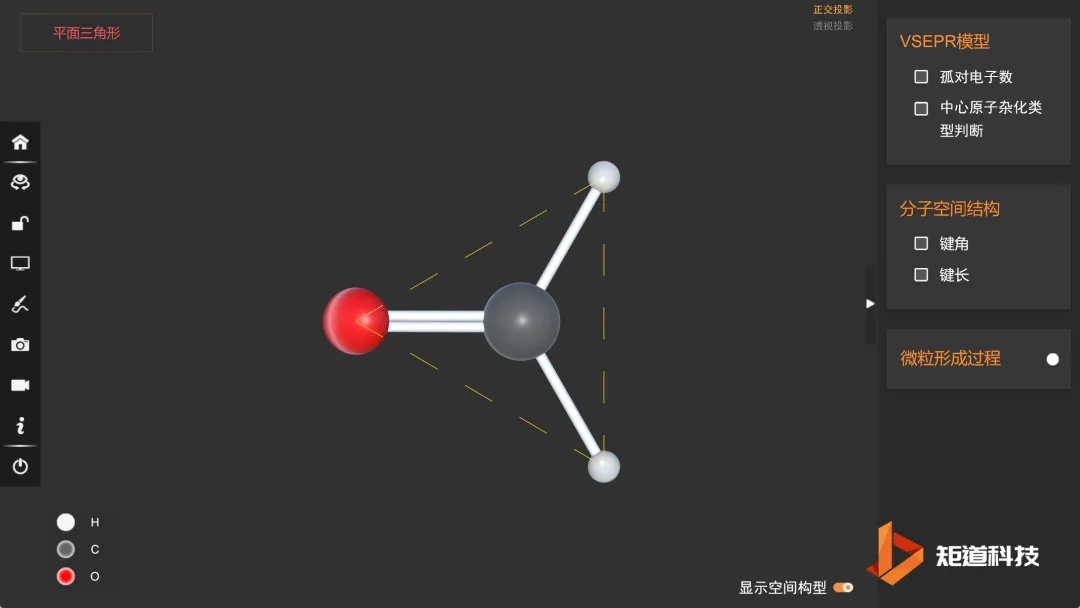
(4)因为C = O之间是双键,C - H之间是单键,根据斥力顺序有:
∠H - C - O>120°>∠H - C - H
因此甲醛分子的空间结构是正三角形畸变形——三角形。
03
解释SO₂F₂与SO₂Cl₂的区别
经过实测,SO₂F₂中∠F-S-F为98°,SO₂Cl₂中∠Cl-S-Cl为102°,为什么后者角度较大?
SO₂F₂和SO₂Cl₂的结构应该近似,均为四面体构型,但是F的电负性大于Cl,因此根据斥力顺序,∠F-S-F的斥力会小于∠Cl-S-Cl间的斥力,所以后者角度较大。
04
其他
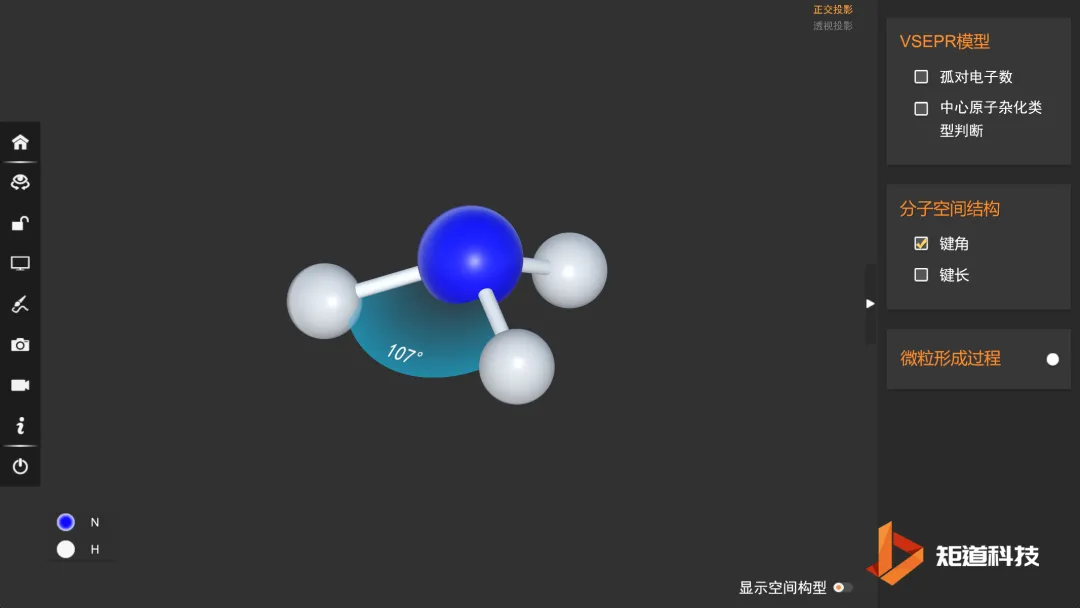
除了之前我们所提的三种斥力顺序以外,处于中心原子的全充满价层里的键合电子之间的斥力大于处于处于中心原子的未充满价层里的键合电子之间的斥力。
比如在NH₃中的键角为106.7°,PH₃中的键角仅有93.5°,其原因在于P原子存在未充满的d轨道。
END
















