
教学目标
重点难点
教学重点:分析氧化还原反应设计原电池。
教学难点:氢氧化钠溶液作电解质溶液时,原电池结构的分析。
教学流程
复习旧知,引入新课
任务一:学生结合锌铜原电池的结构,回忆总结构成原电池的几个条件:
1.有两个活泼性不同的电极;
2.有电解质溶液或熔融电解质;
3.能形成闭合回路;
4.有自发进行的氧化还原反应。

任务二:学生判断下列两个装置能否形成原电池,若是原电池,指出其正负极、标明电子的运动方向和阴离子、阳离子的迁移方向。
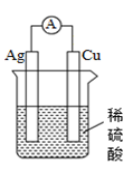
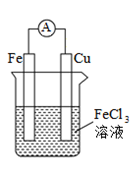
任务三:提出问题“你是如何判断电池正极和负极的?”学生交流讨论,小结正负极的判断方法。
从材料(电极的活泼性)、反应类型(氧化反应还是还原反应)、电子/电流移动方向等角度判断原电池的正负极。
任务四:提出疑问“镁片和锌片作电极的原电池中,铝作正极还是负极?”下面,我们通过实验来探究这个问题。
实验探究
1.提出问题:
小橘:镁片和锌片作电极的原电池中,铝作正极还是负极?
2.作出假设:
针对提出的问题,学生猜想、讨论,老师在学生发言后归纳出猜想:
小白:
①镁片和锌片作电极的原电池中,铝作正极;
②镁片和锌片作电极的原电池中,铝作负极。
(学生可能会由于思维定式,不能想到铝作负极的情况,这种情况下可以在进行完铝作阳极的实验后,引导学生思考想到金属铝可以和氢氧化钠溶液反应的特性,再次进行实验设计和验证。)
3.设计实验:
学生分组讨论,根据氧化还原反应,选择合适的电解质溶液,设计实验,预测实验现象及对应结论。
4.进行实验并记录现象:
学生利用矩道VR化学创新实验室进行实验。
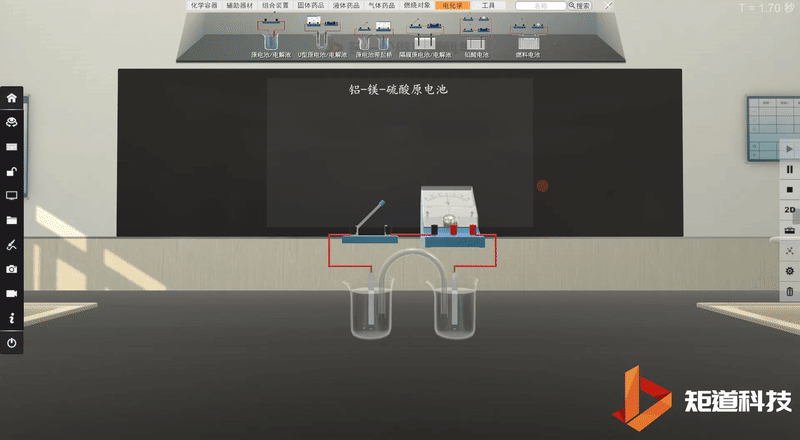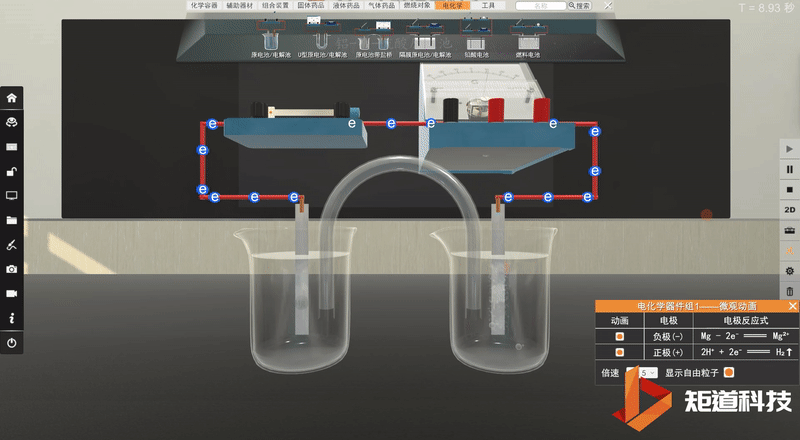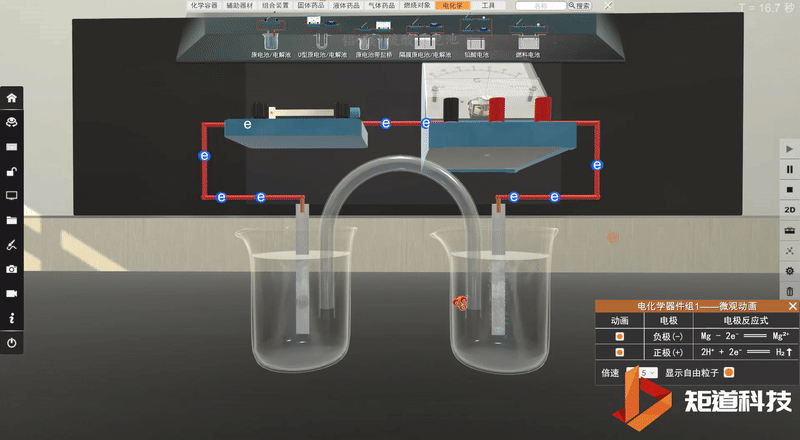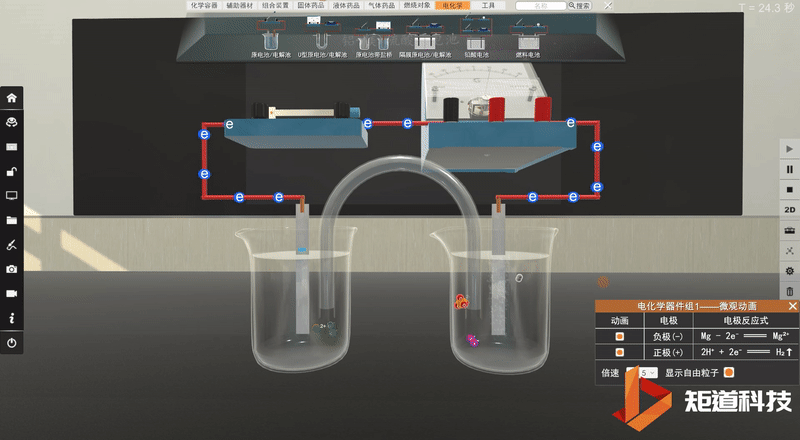
并将实验现象记录在表格中:
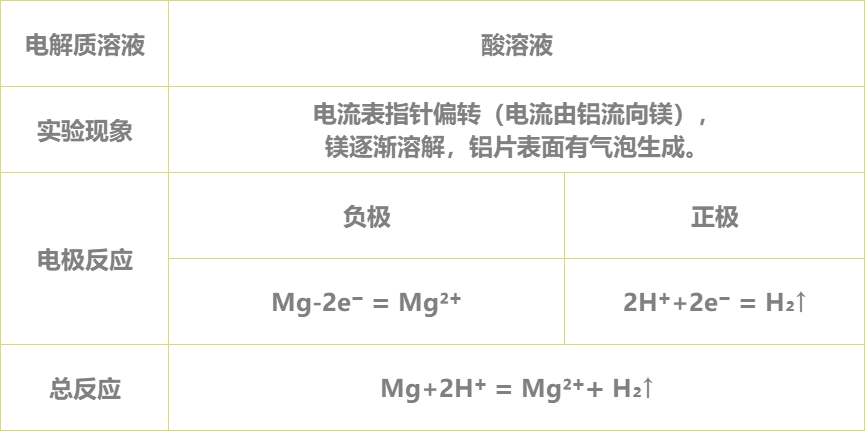
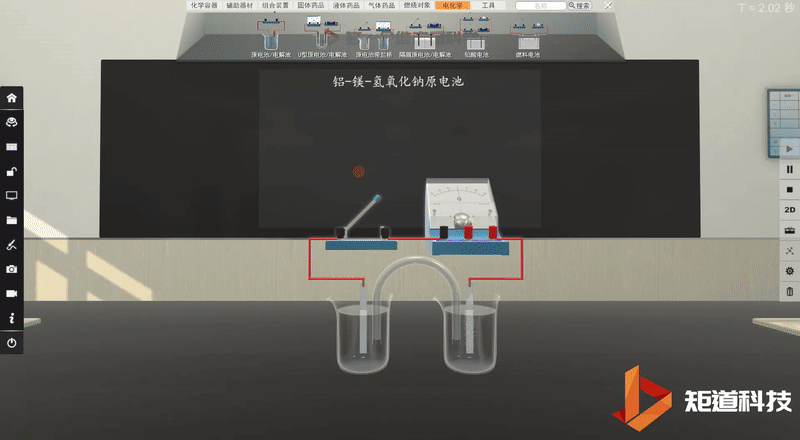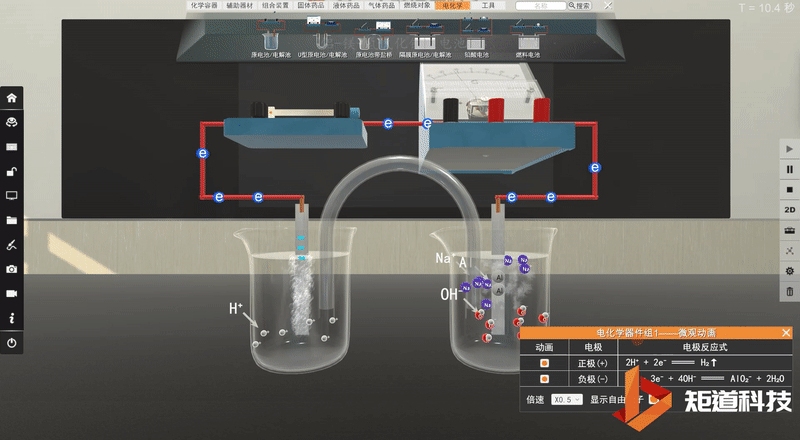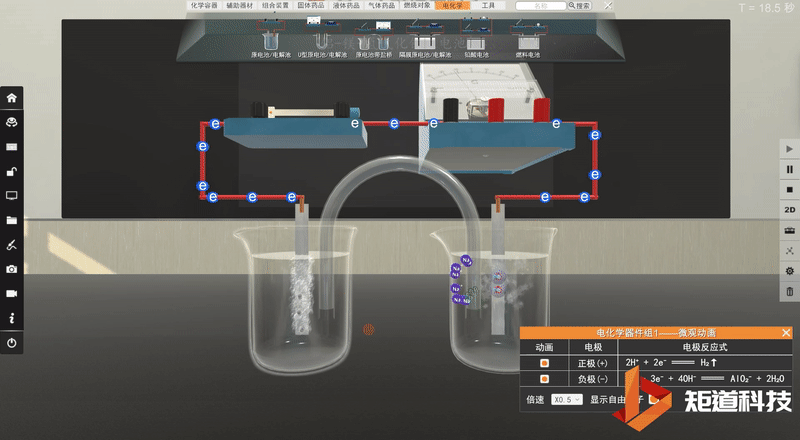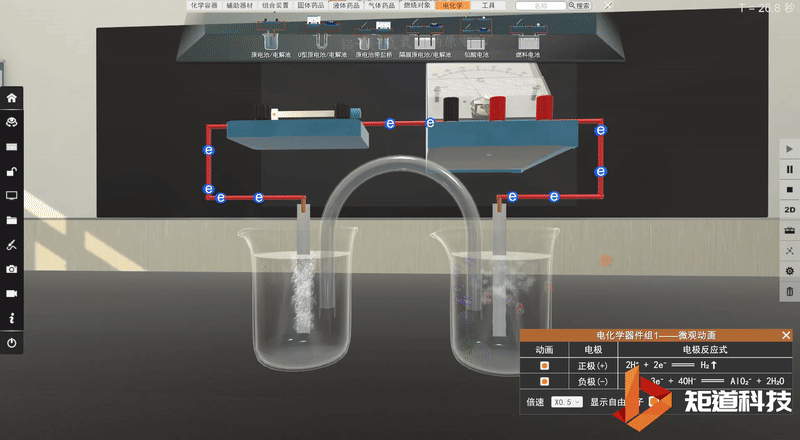
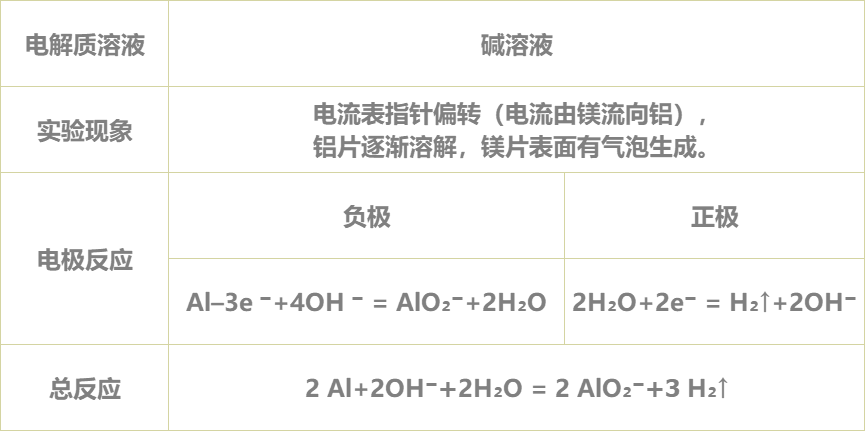
5.得出实验结论:
实验完毕,各小组讨论并汇报结果,教师给予点评反馈,强调活泼金属不一定作负极,判断原电池正负极最根本的是看电子流动的方向,首先确定发生的氧化还原反应,然后分析得失电子情况,失电子的为负极,得电子的为正极。
小结 · 思考
铝、铜与浓硝酸组成原电池时,电池的正负极该如何分析?
END
















