每当化学工程师设计一个化工厂来生产一种新化学品时,他们必须克服一个问题。他们希望从反应物中获得最好的产量,但他们发现大多数化学反应不能完成,因为它们是可逆的。
所有的反应都有趋向于平衡的趋势,不管它们是趋于完全,还是根本不生成生成物。在许多情况下,例如燃料的燃烧,反应物完全转化为产物。
那些似乎根本不发生的反应,比如金在空气中的腐蚀,也倾向于接近平衡。
但在许多反应接近平衡时,其中有大量的反应物和生成物存在。
对于可逆反应:
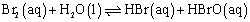
通过实验可以发现在一定温度下反应平衡时,存在如下关系:
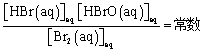
这个常数被称为平衡常数,用Kc表示。
c代表这个常数是用浓度(concentration)计算的,以便与用压强(pressure)计算出的平衡常数Kp区别。
eq代表此浓度为反应平衡时的浓度,通常可以省略。
以下,我们借助矩道化学3D虚拟仿真实验室软件,观察化学反应中的反应平衡现象。


两次溴水浓度并不相同,但是平衡常数都约等于0.02
在给定温度下,平衡常数的值将不随着浓度变换。准确来讲,给定反应的平衡常数只与温度有关。
对于任意反应,其平衡常数的计算式为:
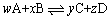
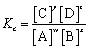
END
















