矩道化学虚拟实验室「物质结构与性质」专题,拥有丰富的VR数字课程资源,提供丰富的原子、分子、晶体结构与性质的微观原理与思维模型可视化情境,解决了实际教学中这部分知识专题“难教、难学、得分率低、可利用的教学素材少”的痛点。让老师轻松教、高效教,让学生喜欢学、自主学!
01
电子排布
电子排布是指电子在原子轨道上的排布。一般来说,最低能量的轨道首先被占据和填满。
例如,氢(H)的电子构型是1s1,因为氢原子中唯一的电子会填充到能量最低的1s轨道。

H原子的电子排布式
氦(He)的电子构型是1s2而不是1s12s1,这是因为1s轨道可以容纳两个电子,而1s轨道上的电子能量比2s轨道上的电子低。

He原子的电子排布式
02
预测电子排布
但是并不是层数越低能量就越低,例如钾(K)的电子构型是1s22s22p63s23p64s1,而不是可能期望的1s22s22p63s23p63d1。

K原子的电子排布式
对于钾原子和钙原子来说,4s轨道的能量都低于3d轨道的能量。这意味着钙(Ca)的电子构型是1s22s22p63s23p64s2而不是1s22s22p63s23p63d2。
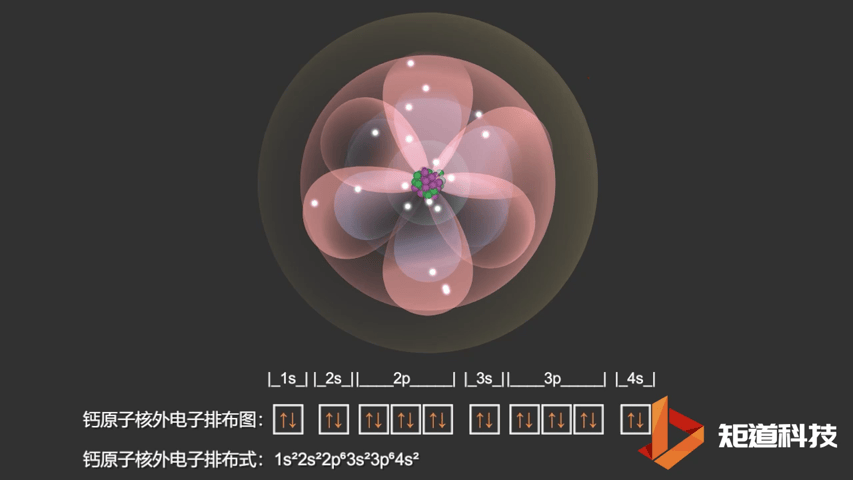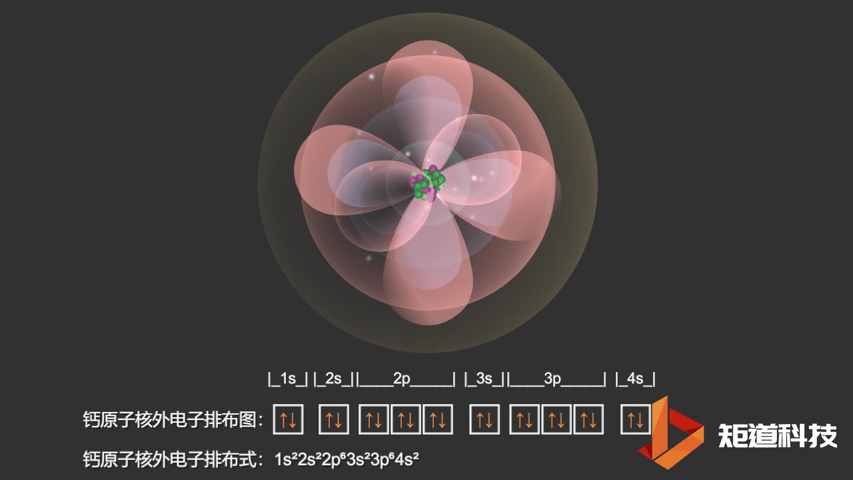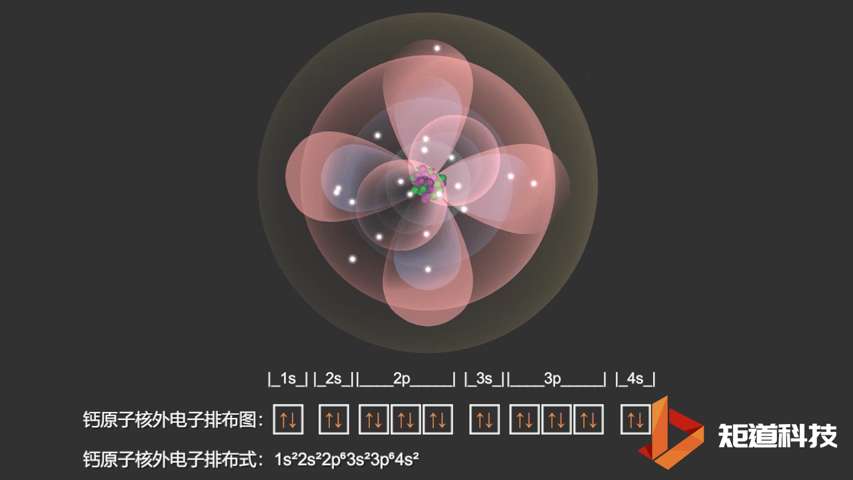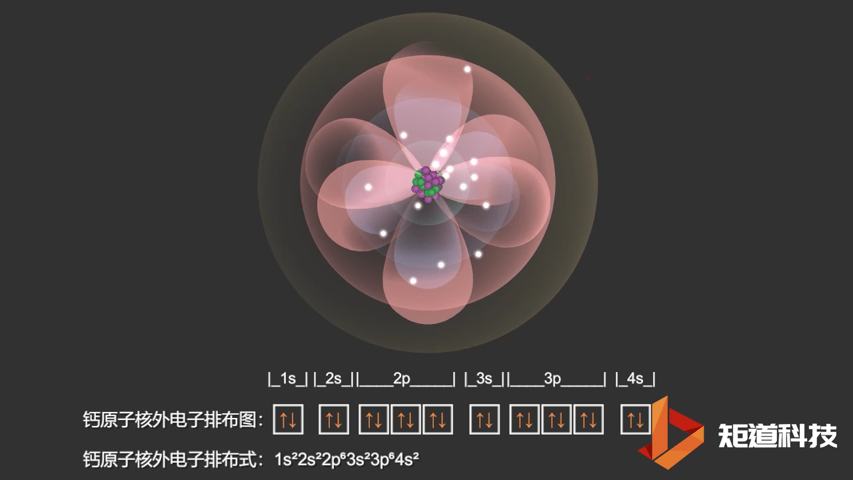
Ca原子的电子排布式
03
洪特规则和泡利不相容原理
洪特规则指出,填入简并轨道的电子在配对发生之前会单独占据轨道,且自旋平行。
泡利不相容原理指出,两个电子不能占据同一个轨道,除非它们有相反的自旋。
洪特规则和泡利不相容原理决定了电子填充p和d亚壳层的方式。
如果我们对硼(B)、碳(C)和氮(N)应用洪特规则,我们得到以下电子构型:
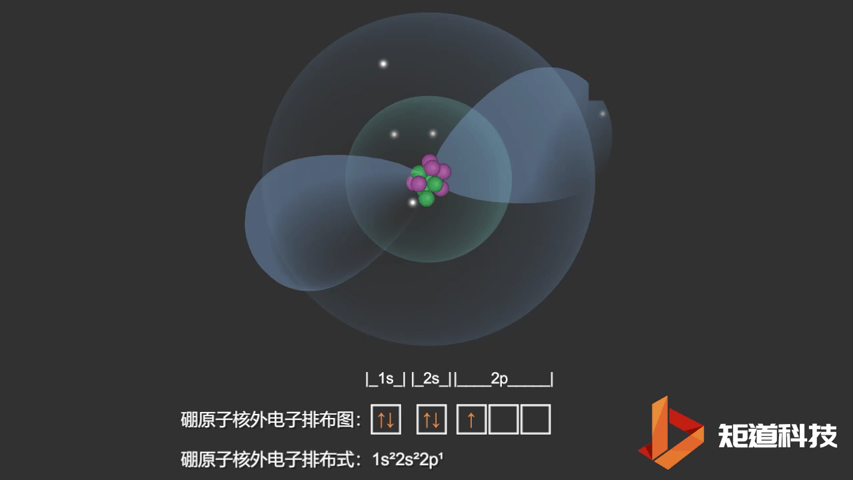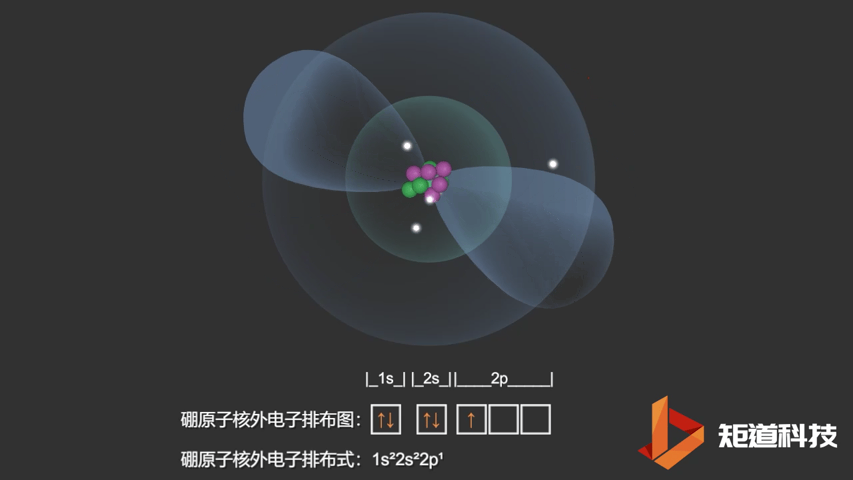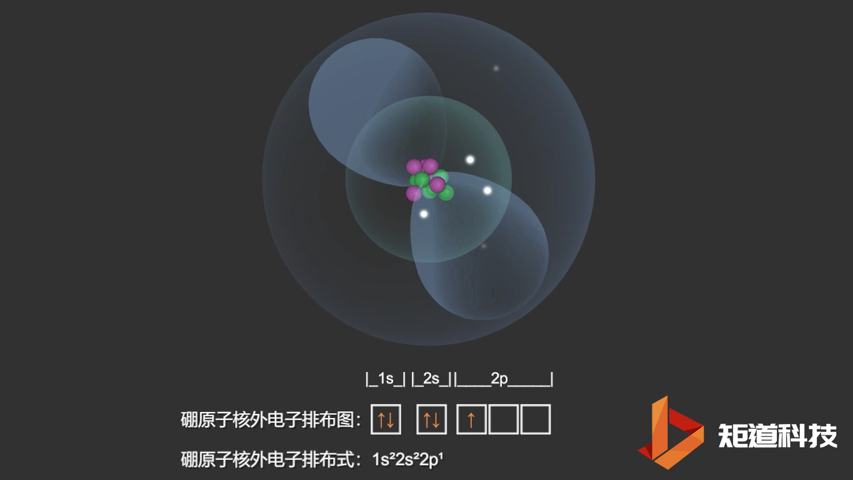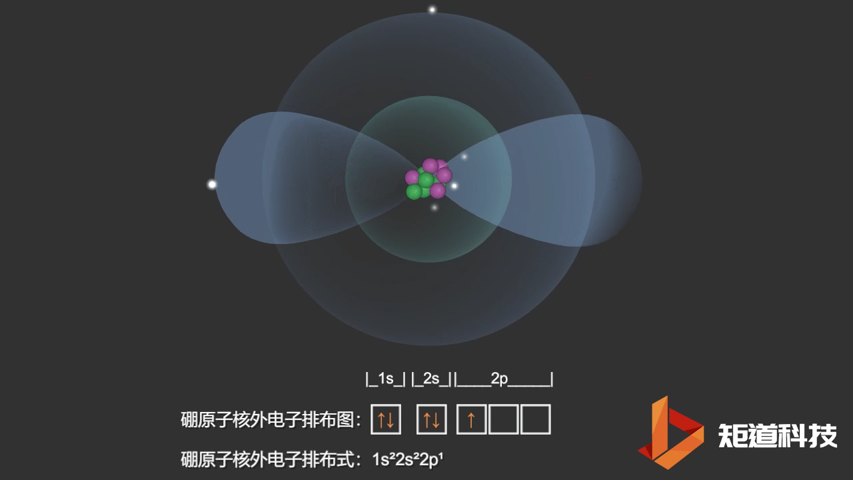
B原子的电子排布式
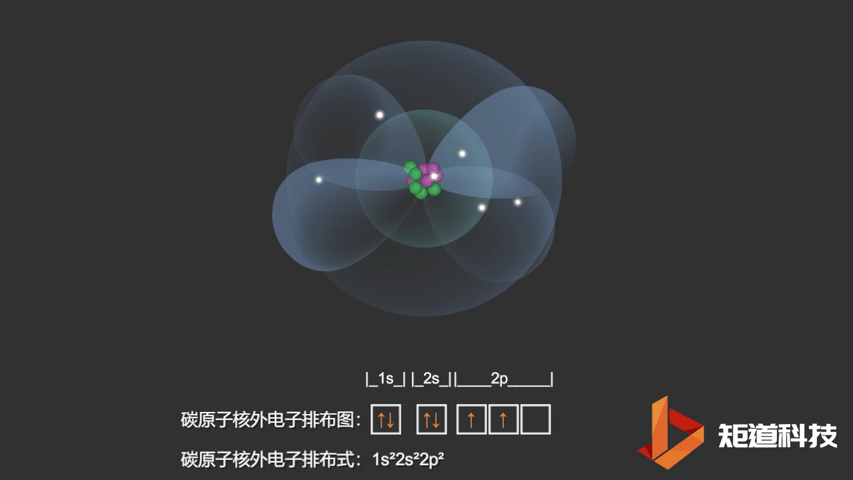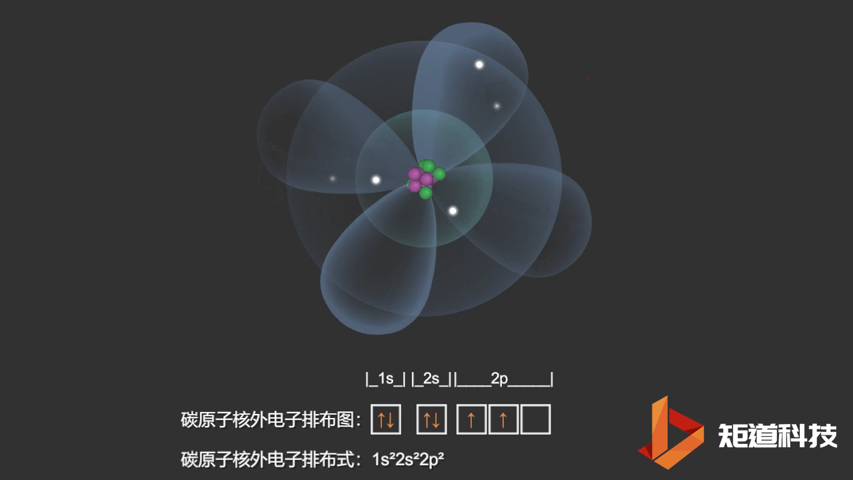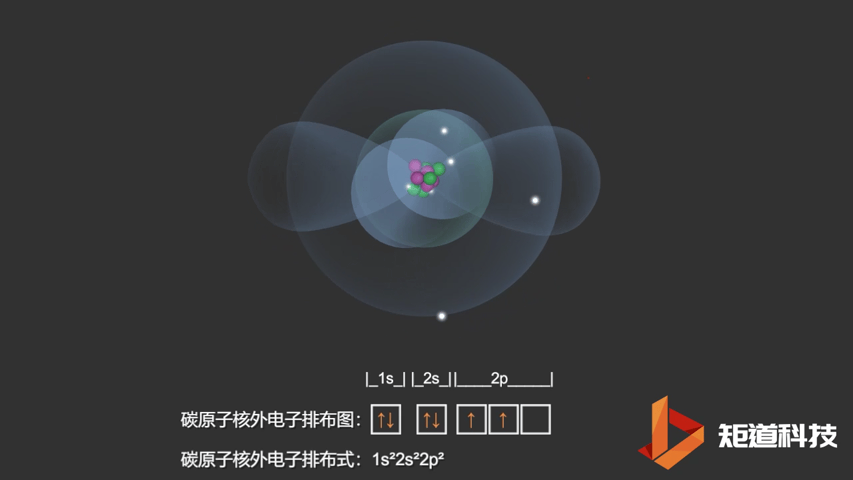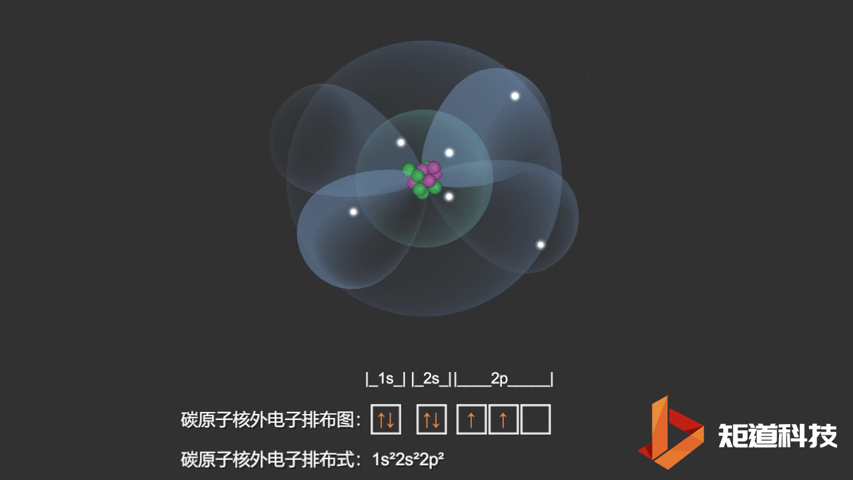
C原子的电子排布式
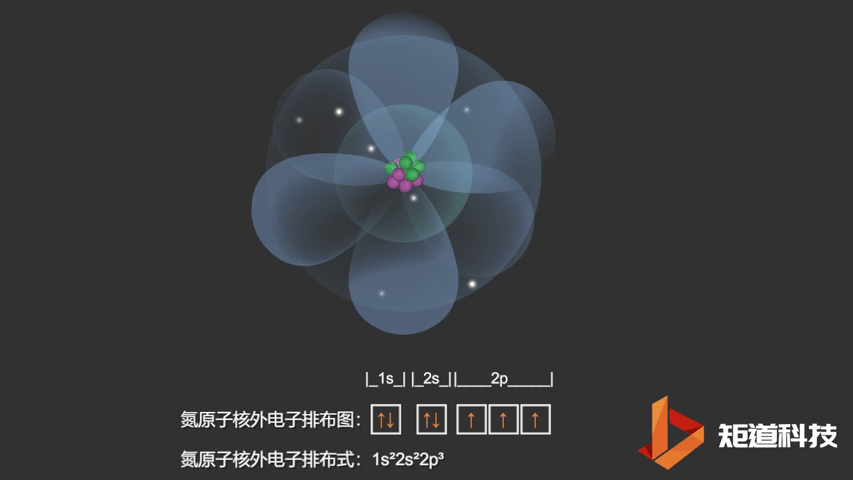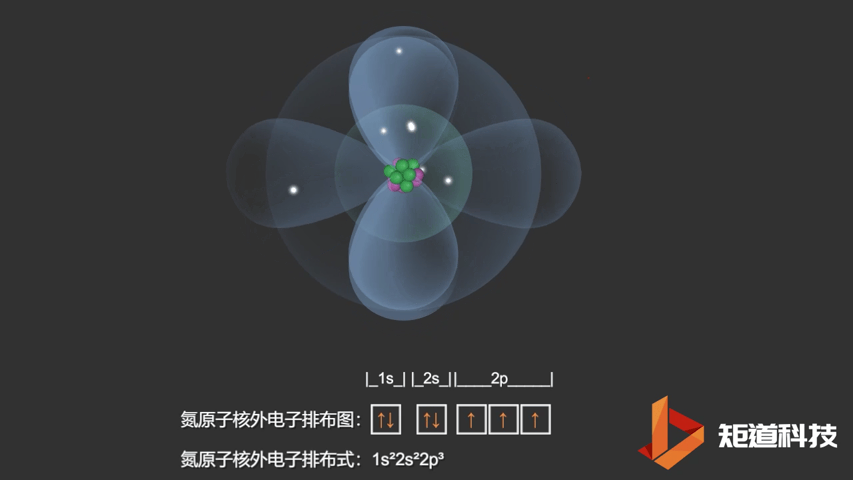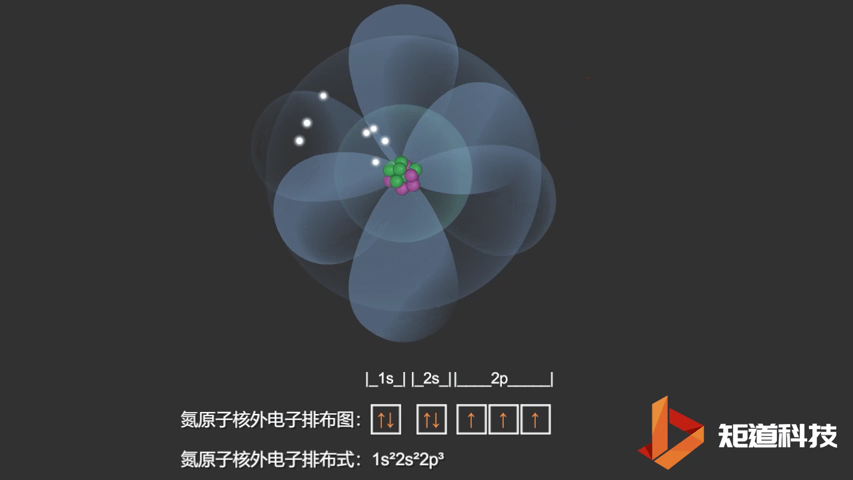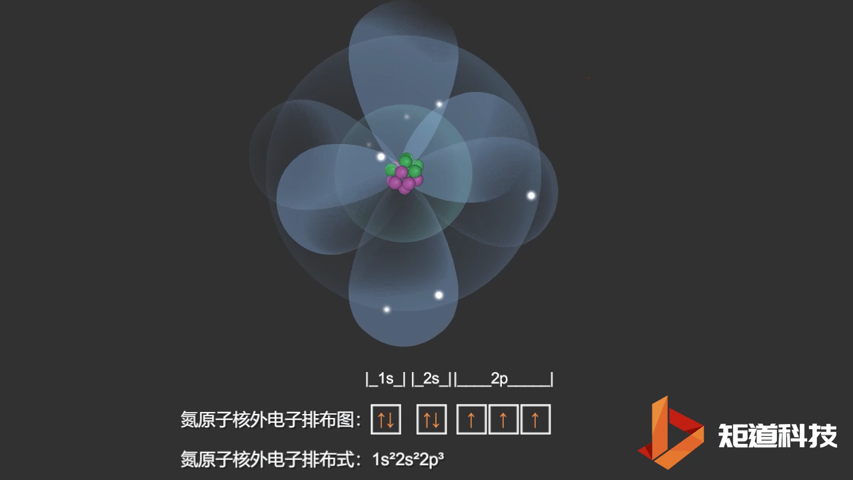
N原子的电子排布式
相应的,对于氧(O)、氟(F)、氖(Ne)应用泡利不相容原理,会得到如下电子构型:
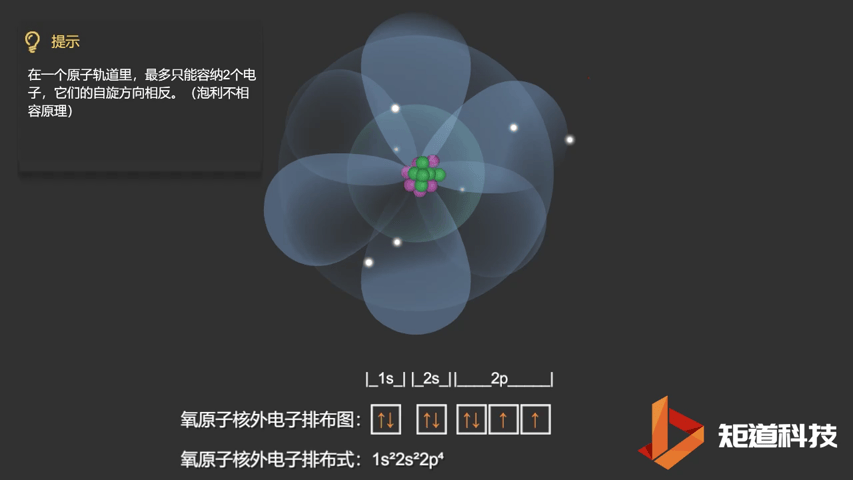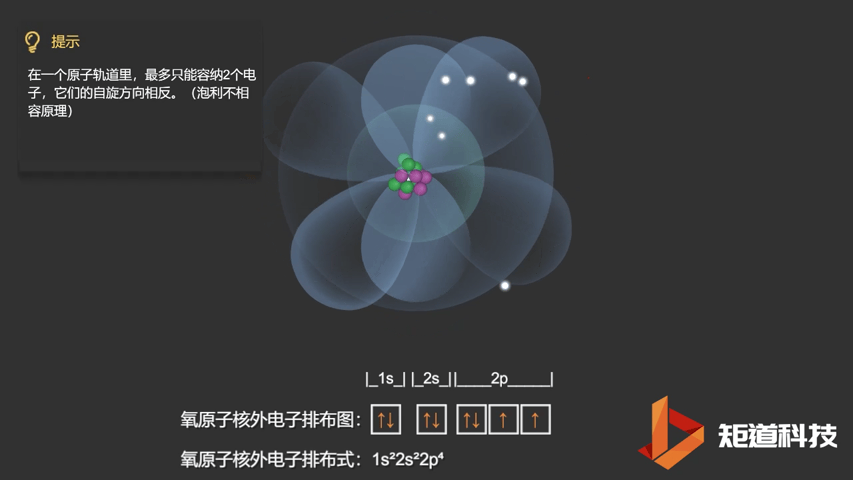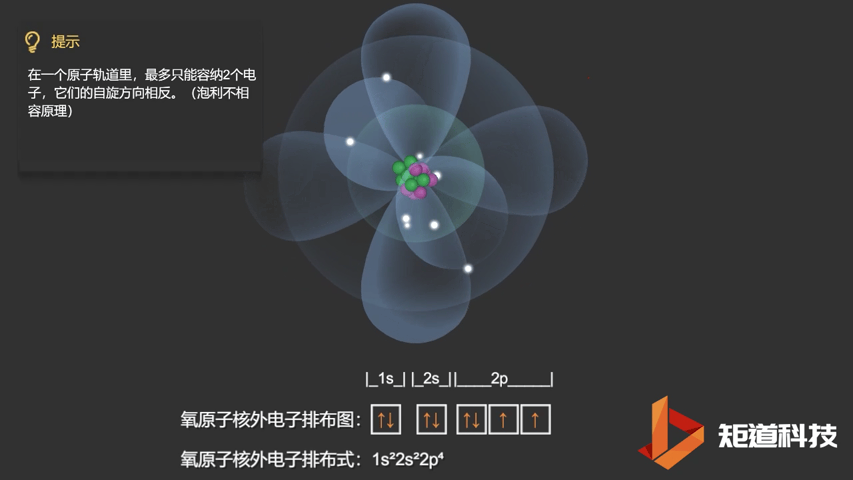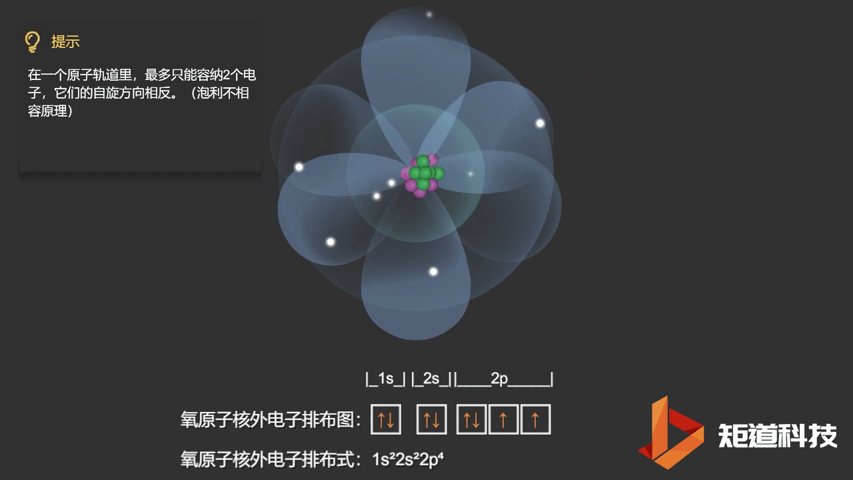
O原子的电子排布式
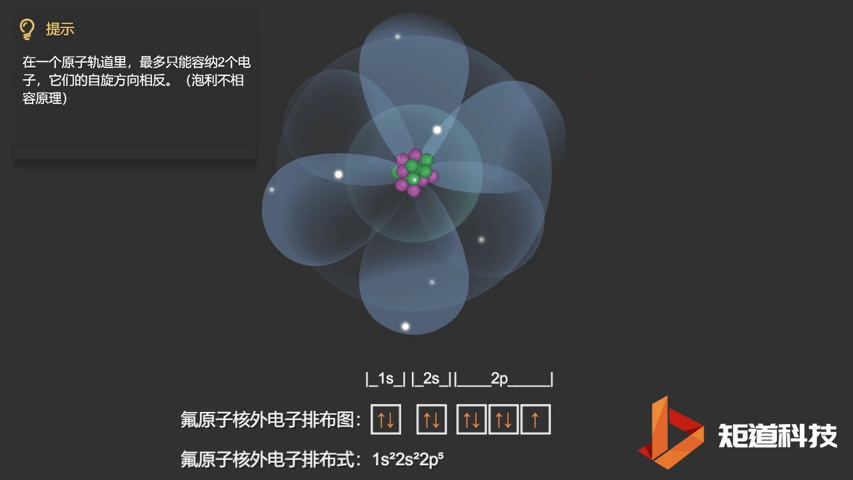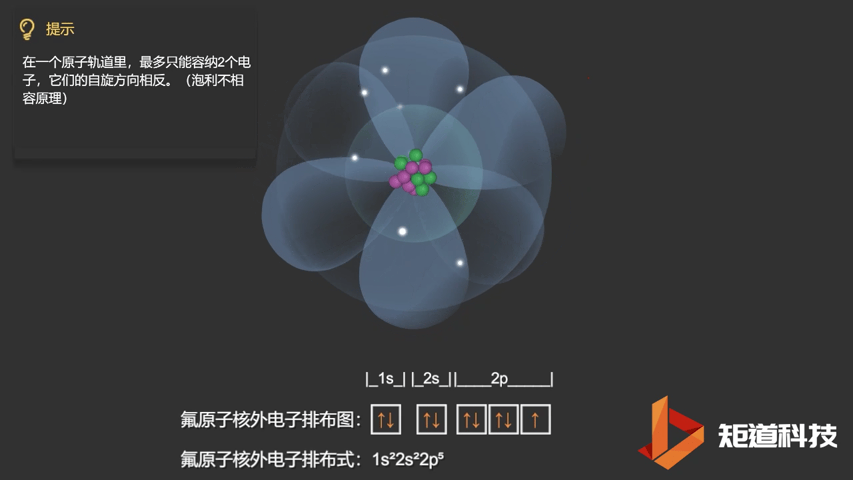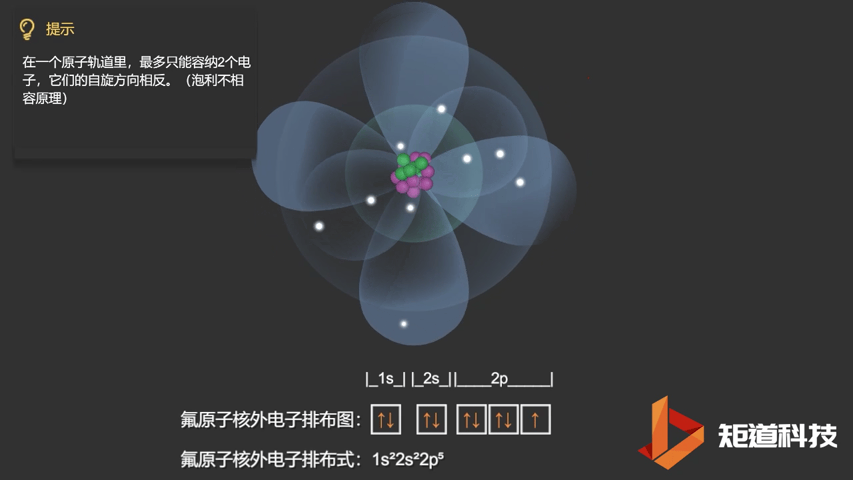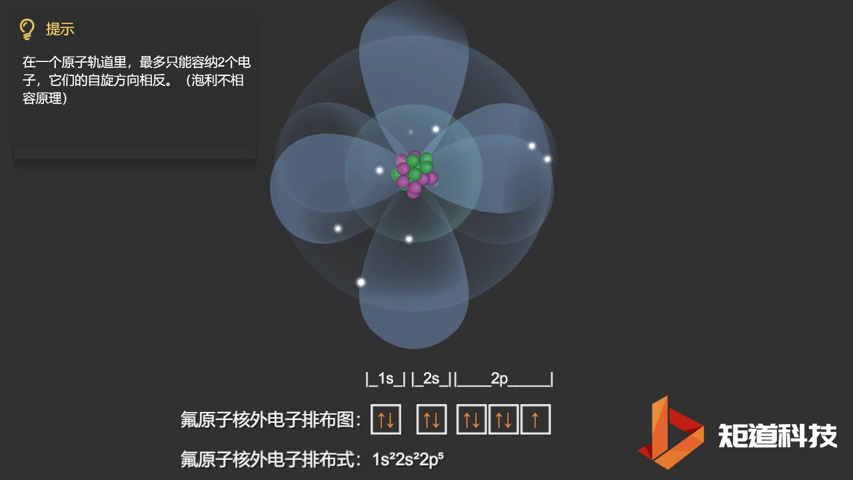
F原子的电子排布式
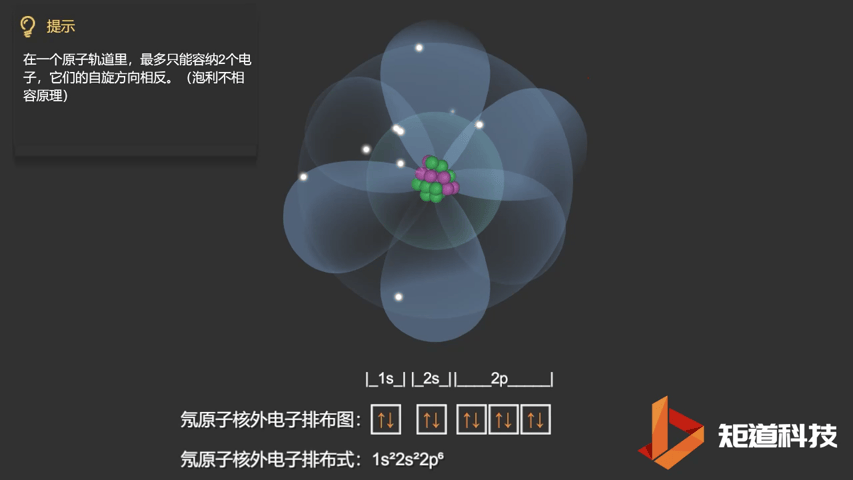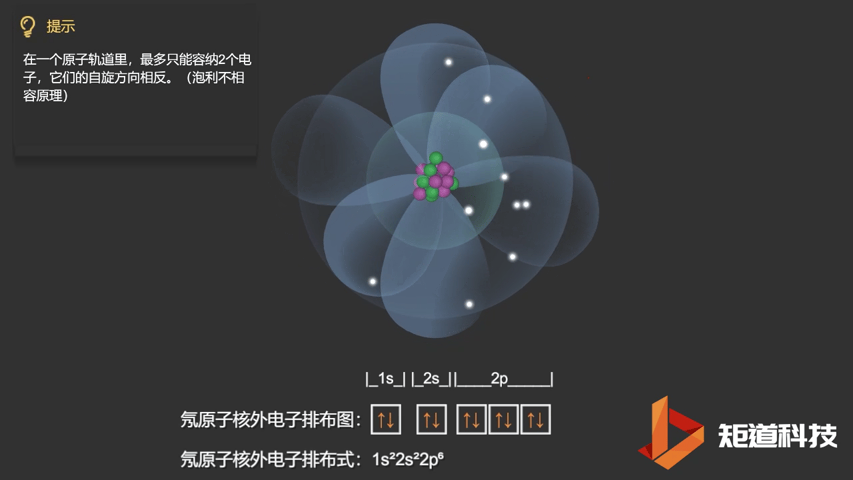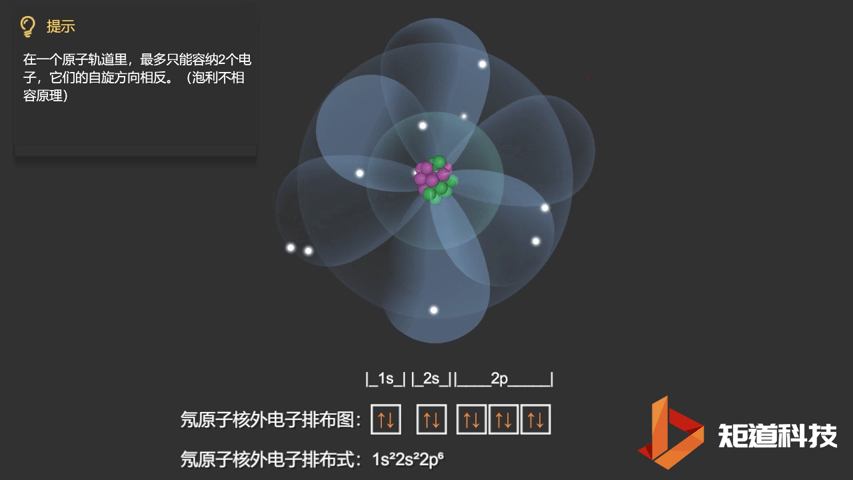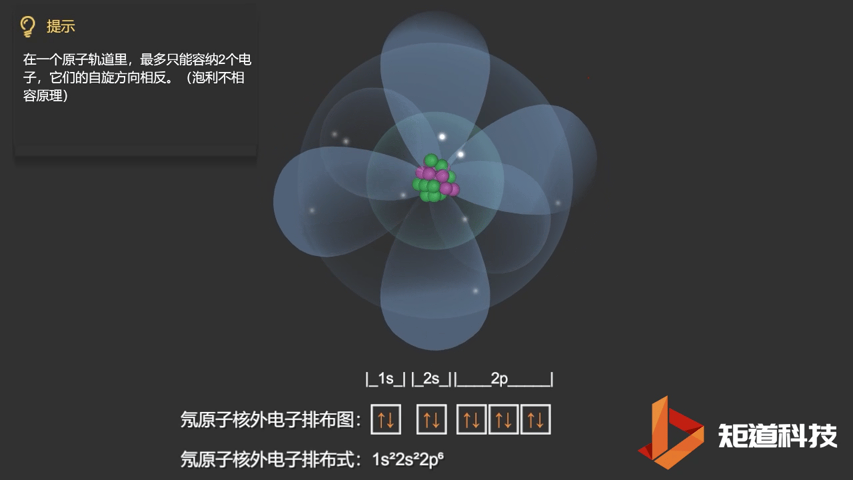
Ne原子的电子排布式
















