本课程主要讲解原子的核外电子排布规律,借助矩道化学虚拟实验室软件中的[物质结构与性质]模块,打造VR数字课程,能够动态展示核外电子云的形态及电子的排布规律等教学难点。
随着原子序数的增加,基态原子的核外电子数量也越来越多,由于电子间存在复杂的瞬时相互作用,薛定谔方程的形式与求解越加越复杂。经过科学家的努力,引入多种近似算法,得到了各种原子的核外电子排布。
在此过程中,科学家们发现原子的核外电子排布遵循下面3个原则:
(1)泡利不相容原理——在一个原子中,没有两个电子有完全相同的4个量子数。在上篇文章中,我们知道前3个量子数可以确定原子轨道,而自旋磁量子数有两个值±1/2,这就意味着每个原子轨道最多只能排2个电子,而且它们的自旋状态必须不相同,对应的自旋磁量子数分别为+1/2和-1/2;
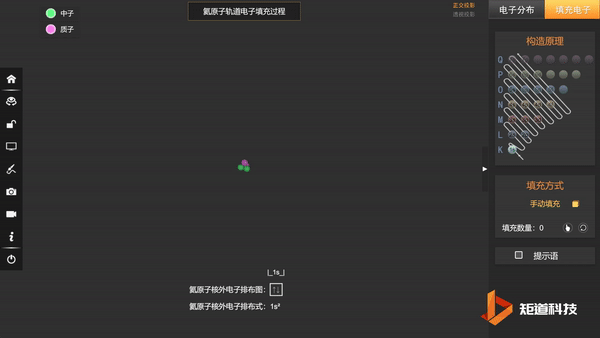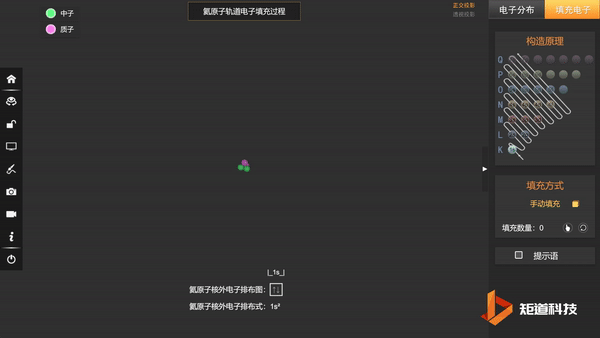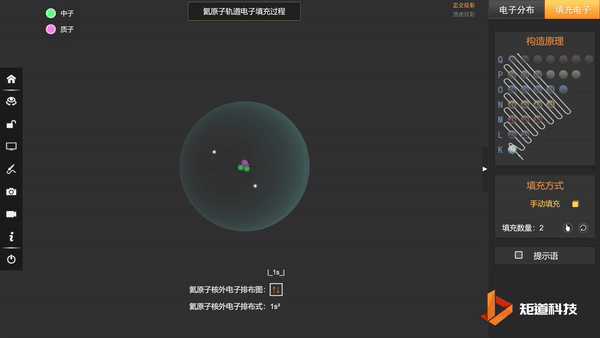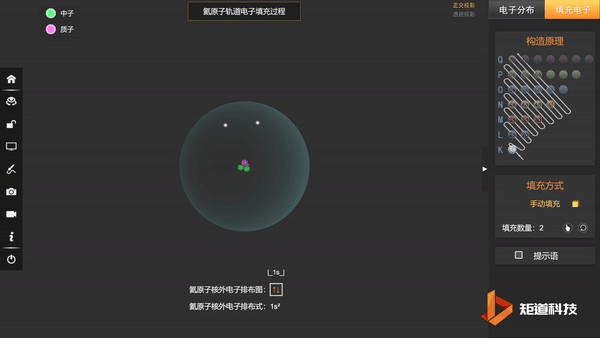
He的1s轨道两个电子自转方向不同,以↑和↓区分
(2)能量最低原理——在不违背泡利不相容原理的前提下,电子优先占据能级较低的原子轨道,使整个原子体系的能量最低,这样的状态被称为原子的基态;
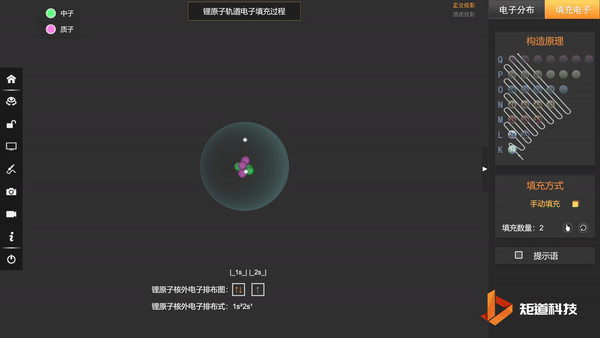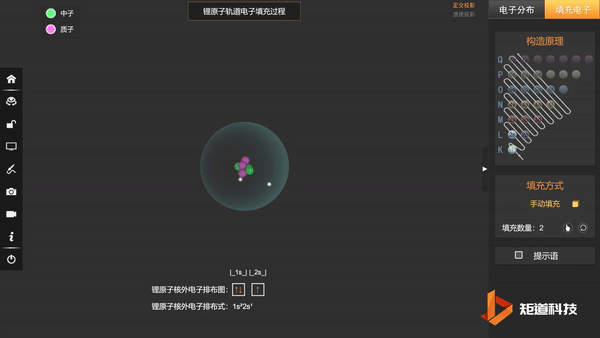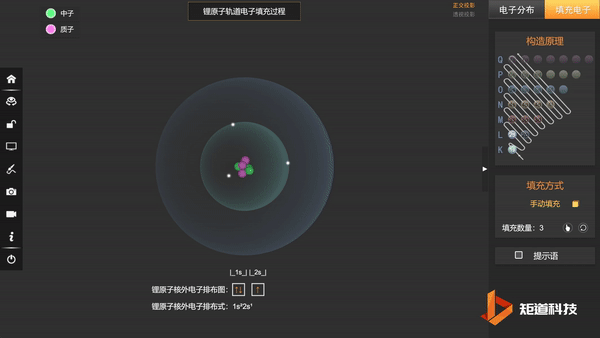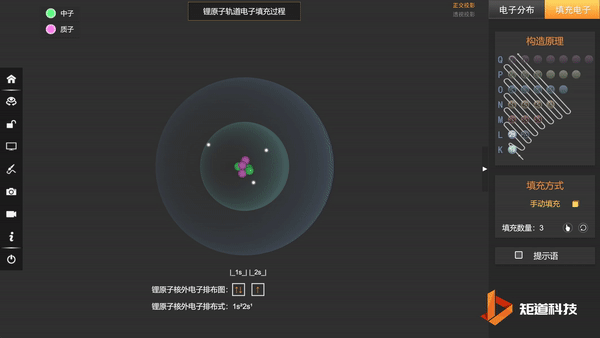
基态Li的第三个电子填充在2s上,不会在更高能级上
(3)洪特规则——在能级高低相同的轨道上,电子尽可能分占不同的轨道,且自旋相同。
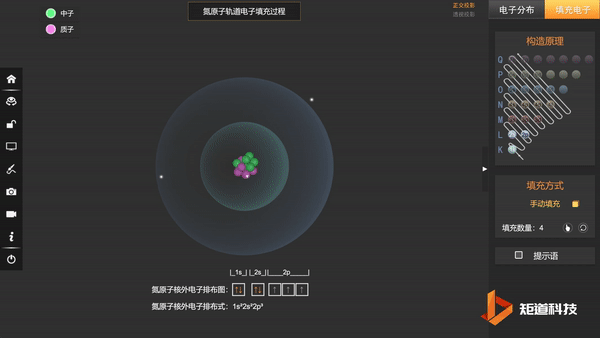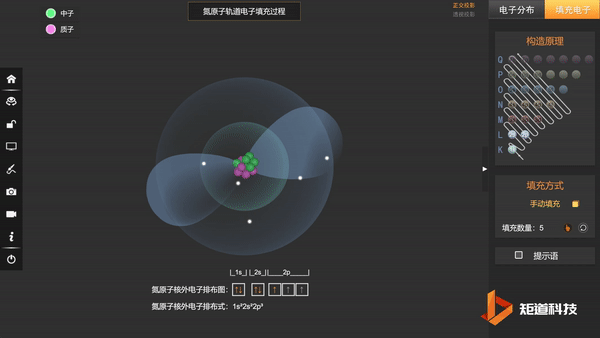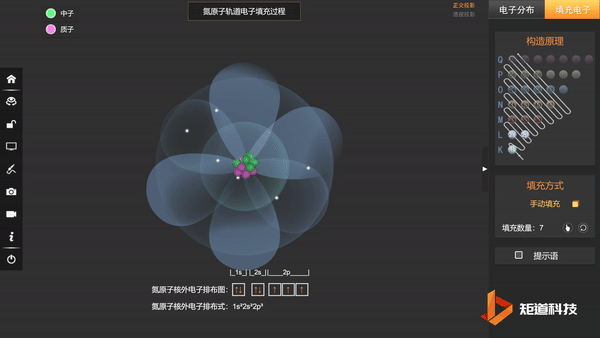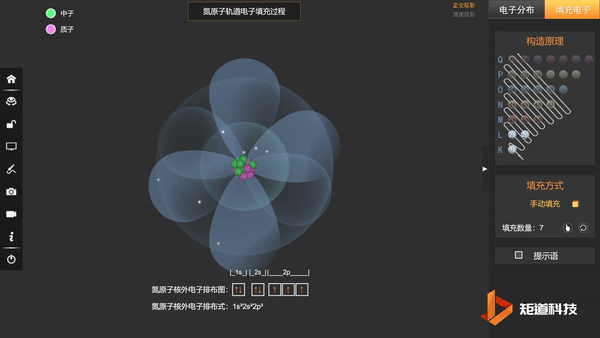
N的3个2p电子会平均填充在3个2p轨道上
作为洪特规则的补充,能级高低相等的轨道上全充满或者半充满的状态比较稳定,因为此时电子云分布近似球形。
根据上述原则,可将核外电子进行填充,这种规律称为“构造原理”。电子在原子轨道中的填充顺序一般为:
1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s、5f、6d……
或者可以参考下图中的箭头顺序:

基态原子的核外电子填充顺序图
在这个顺序中,3d排在4s之后,4d排在5s之后,4f、5d排在6s之后,5f、6d排在7s之后,使得元素周期中过渡元素“延迟”到IIA主族后出现。
核外电子排布式一般可按上述规则写出,例如原子序数为20的Ca:
Ca:1s² 2s² 2p⁶ 3s² 3p⁶ 4s²
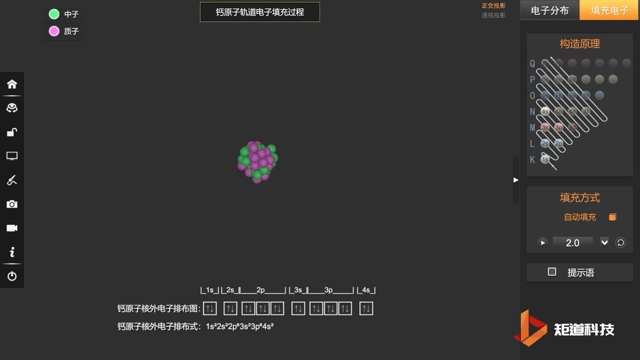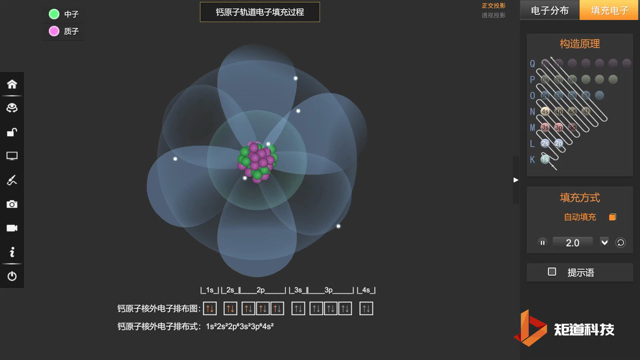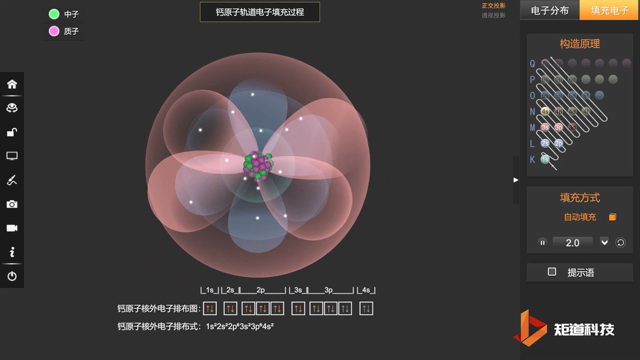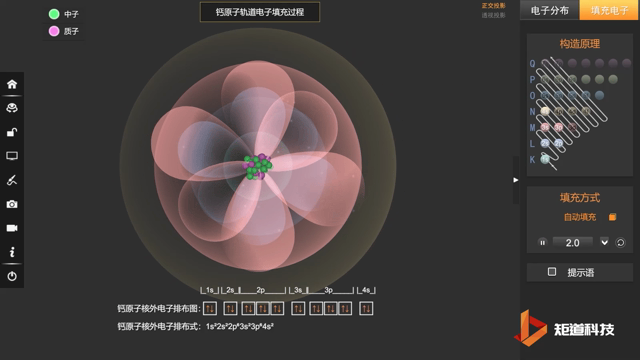
也会采取简化写法:Ca:[Ar] 4s²
其中[Ar]指内层电子组态与稀有元素Ar的基态核外电子组态相同,4s²对应的就是Ca的价电子层。
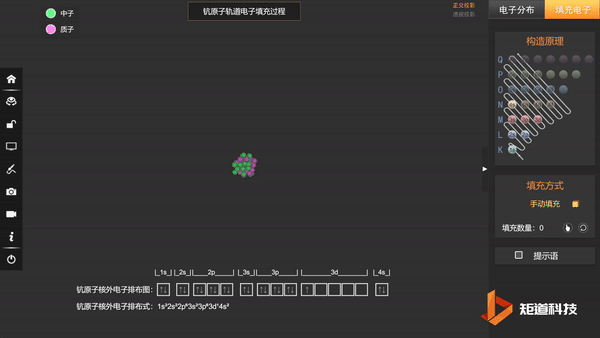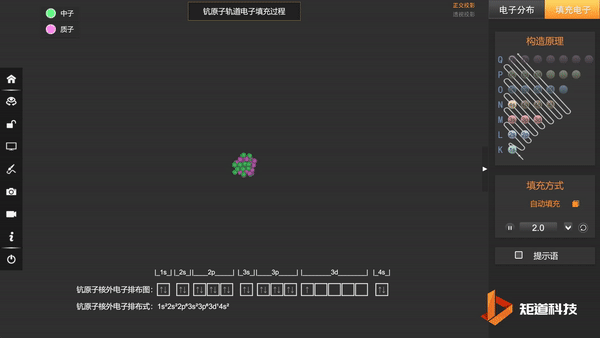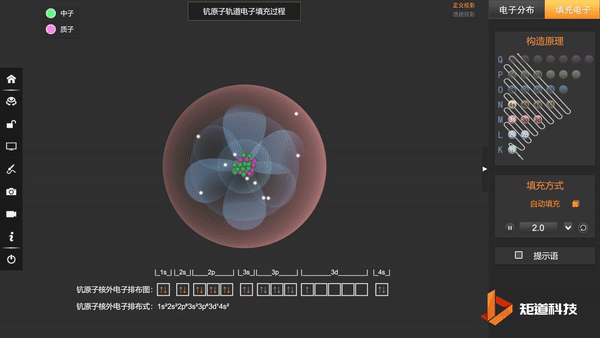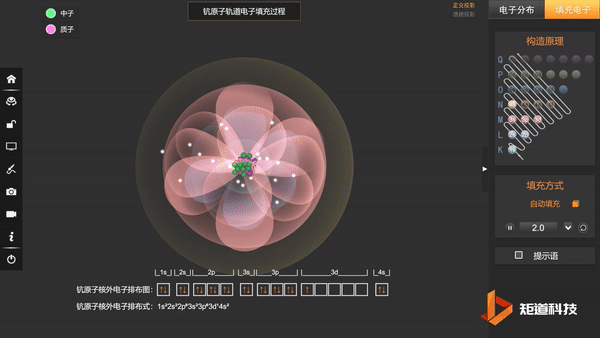
到原子序数为21的Sc时,增加的1个电子排在了3d轨道上,而没有排在和4s主量子数相同的4p轨道上:
Sc:1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹ 4s²
或Sc:[Ar] 3d¹ 4s²
值得注意的是,虽然此时3d的电子是在4s之后才排,但是我们书写核外电子排布式的时候仍然会按照主量子数大小顺序将3d写在4s之前。
同时要指出的是,构造原理只是给出了基态原子外层电子在原子轨道上排布的规律,并不代表电子填充后在原子中各原子轨道的能级高低顺序。
例如,对于3d和4s轨道都有电子的原子,在很多情况下,3d轨道上的电子能量更低。
END
















