【矩道化学】人教版必修课程之《钠及钠的化合物》
更新时间:2022-02-15 来源:矩道科技 浏览:0
矩道化学仿真实验室:本课程需掌握金属钠、钠的氧化物、氢氧化物、主要物理性质,掌握钠分别与氧气、水、酸、盐等物质的反应,氧化钠、过氧化钠与水、酸等物质反应的情况,掌握焰色反应的原理及操作等
钠单质的性质:
物理性质:
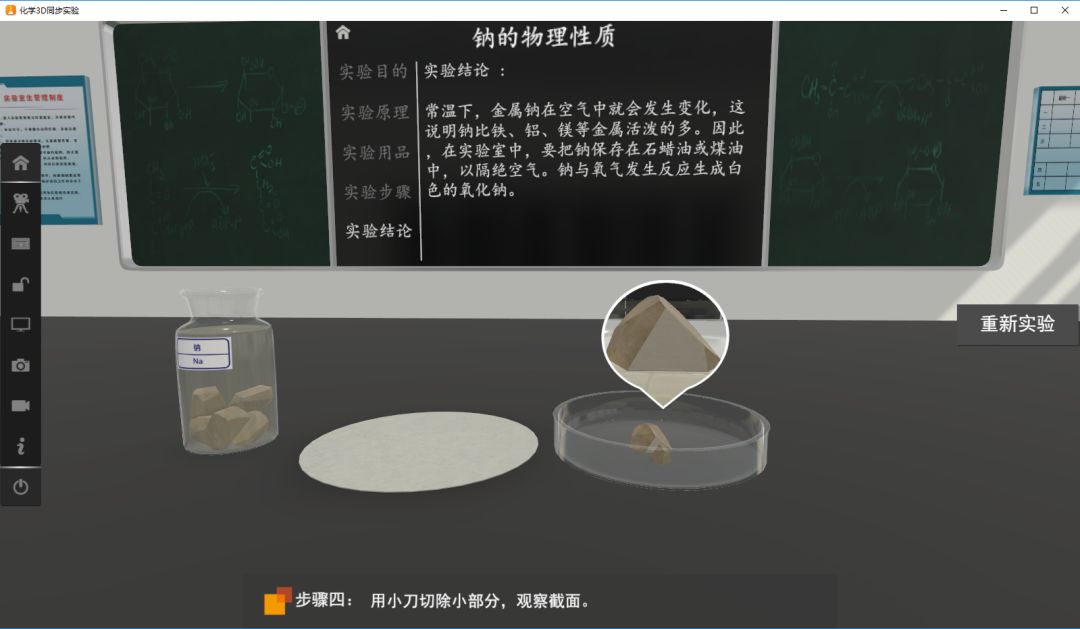
在自然界中,因其化学性质活泼,钠只以化合态形式存在,钠元素的主要存在形式是氯化钠。
钠的密度比水小,且硬度很小,可以用小刀切割。块状钠单质是银白色金属,没有粉末状的钠。钠的熔点低,钠与水反应产生的热量就可以使其融化成小球。
化学性质:
1.与氧气反应:
常温:钠被氧化成白色的氧化钠。
加热:白色钠燃烧发出黄光,生成淡黄色的过氧化钠。


2.与水的反应:

反应方程式: 2Na + 2H₂O=2NaOH + H₂↑
钠在常温下就能与水发生反应,反应现象可概括为:浮、熔、游、响、红。
钠跟水的反应的现象的解释:浮:钠的密度比水小;熔:反应放热,钠熔点低熔化成小球;游:反应产生气体;响:反应剧烈;红:生成NaOH,酚酞遇碱变红 。
3.与盐溶液的反应:
①钠与明矾溶液的离子反应:
2Na+2H₂O=2Na⁺ +2OH⁻ + H₂ ↑
Al³⁺ +3OH⁻=Al(OH)₃ ↓
Al³⁺ +4OH⁻=AlO₂⁻ +2H₂O;
②钠与氯化铁溶液的离子反应:
2Na+2H₂O=2Na⁺ +2OH⁻+H₂ ↑
Fe³⁺ +3OH-=Fe(OH)₃ ↓;
③钠与硫酸铜溶液的离子反应:
2Na+2H₂O=2Na⁺ +2OH⁻ +H₂ ↑
Cu²⁺ +2OH⁻=Cu(OH)₂↓;
4.与乙醇反应:
钠与有机物中的羟基反应,发生置换反应,生成氢气,反应的方程式为:2Na+CH₃CH₂OH=CH₃CH₂ONa+H₂↑
除乙醇外,还能与钠发生置换反应的有机物有:醇类(含有-OH),羧酸(含有-COOH),以及苯酚这样的物质。
钠的氧化物
钠的常见氧化物有氧化钠和过氧化钠。
氧化钠为白色无定形片状或粉末。对湿敏感。在暗红炽热时熔融,到400℃以上时分解成过氧化钠和金属钠。遇水起剧烈化合反应,形成氢氧化钠。具腐蚀性、强刺激性,可致人体灼伤。对人体有强烈刺激性和腐蚀性。
过氧化钠是钠在氧气或空气中燃烧的产物之一,纯净的过氧化钠为白色,但一般见到的过氧化钠呈淡黄色,原因是反应过程中生成了少量超氧化钠。过氧化钠易潮解、有腐蚀性,应密封保存。
1.氧化钠与水反应:
Na₂O+H₂O=2NaOH ;
离子方程式:
Na₂O+H₂O=2Na⁺ +2OH⁻
2.过氧化钠与水的反应:
2Na₂O₂+2H₂O=4NaOH+O₂ ↑;
离子方程式:
2Na₂O₂+2H₂O=4Na⁺ +4OH⁻ +O₂ ↑
钠盐:
绝大部分钠盐都易溶于水,中学阶段,常见的钠盐为氯化钠、硫酸钠、碳酸钠和碳酸氢钠。
碳酸钠、碳酸氢钠的物理性质和化学性质
(1)物理性质:
碳酸钠:常温下为白色无气味的粉末或颗粒,有吸水性,易溶于水。
碳酸氢钠:常温下为白色细小晶体,在水中的溶解度小于碳酸钠。
(2)化学性质:
①与盐酸的反应:
Na₂CO₃+2HCl=2NaCl+H₂O+CO₂↑
NaHCO₃+HCl=NaCl+H₂O+CO₂ ↑
②与氢氧化钠溶液反应:
NaHCO₃+NaOH= Na₂CO₃+H₂O
③与澄清石灰水反应:
碳酸氢钠与澄清石灰水反应量不同产物不同:
NaHCO₃(少量)+Ca(OH)₂=CaCO₃ ↓+NaOH+H₂O
2NaHCO₃(过量)+Ca(OH)₂=CaCO₃ ↓+Na₂CO₃+2H₂O
碳酸钠和碳酸氢钠的鉴别方法
(1)定性检验法:
①取少量固体盛于固体制氧装置中,加热,将导管伸入装有澄清石灰水的试管中,石灰水变浑浊,说明固体是碳酸氢钠,否则是碳酸钠。
②取少量固体溶解,加入氯化钙溶液,产生沉淀是碳酸钠溶液,否则是碳酸氢钠溶液。
(2)定量检验法:
①分别向等量的白色粉末中加等体积、等浓度的稀盐酸,生成气体快的是碳酸氢钠,慢的是碳酸钠。
②分别向等量的白色粉末中加等体积适量的水,固体溶解量的多的碳酸钠,少的是碳酸氢钠。
用途:
钠单质的用途:
利用钠元素的特征焰色(黄色)制高压钠灯,高压钠灯的透雾力强,可以做航标灯;利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反应堆的导热剂;利用钠单质制备过氧化钠,利用钠单质还原熔融态的四氯化钛制备金属钛。
钠化合物的用途:
过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;NaHCO3治疗胃酸过多症的一种药剂。氯化钠做为制备单质钠和氯气的原料,氯化钠做为制备氢氧化钠、氢气、氯气的原料。Na2CO3用于玻璃、制皂、造纸、纺织等工业中;还可以用来制造其他钠的化合物。
















