在高中阶段的化学学习中,配合物是一个非常重要的概念,因为它涉及到了许多方面的知识,如化学键、化学反应、化学平衡等。

借助高中化学虚拟实验室软件,能够将此类抽象的原理动态可视化的呈现出来,使老师的教学不再停留在表面,可以更容易引导学生进行解释。利用虚拟现实技术对提升物质结构与性质教学效果、提高学生的学习效率具有促进作用。
配合物是内轨型还是外轨型,主要取决于中心离子/原子的电子构型、电荷数和配位原子的电负性大小。
01
中心离子/原子电子构型
一般来说,形成体电子构型的影响大致分下列三种情况:
(1)具有 d¹⁰构型的离子常形成外轨配键,因为这些离子次外层 d 轨道处于全充满状态只能用外层轨道成键。例如:[Ag(NH₃)₂]⁻、[AgCl₂]⁻、[Au(CN)₂]⁻、[Zn(NH₃)₄]²⁺ 、[ZnCl₄]²⁻等,其中Ag⁺、Au⁺、 Zn²⁺均为 d构型,形成体分别采取 sp或 sp³杂化形成外轨配合物。
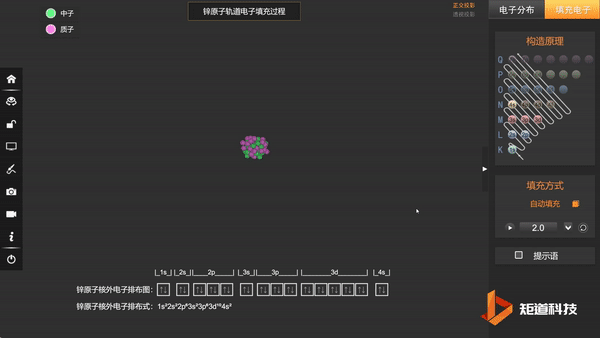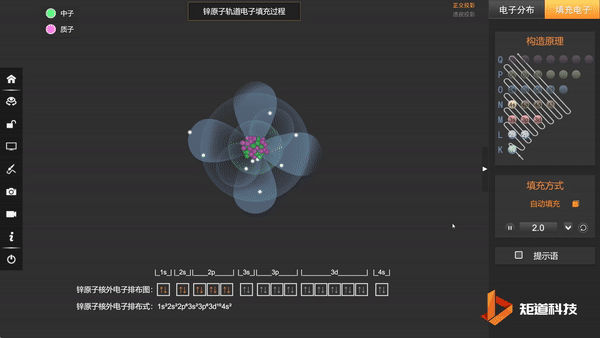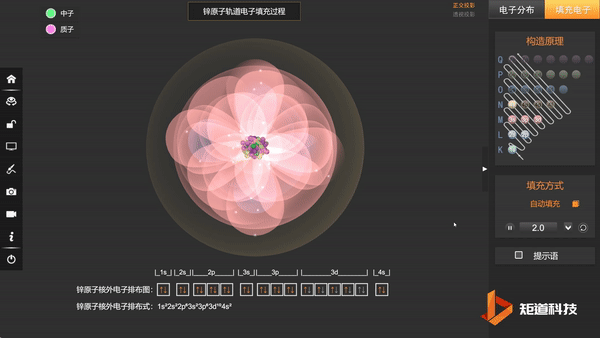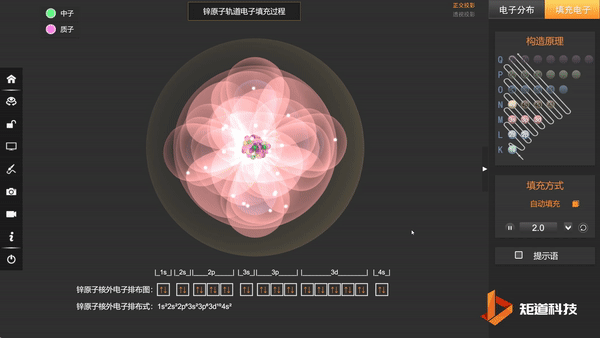
Zn原子的核外电子排布,在失去两个电子后价电子为3d¹⁰
(2)具有d¹~d³构型的离子至少可提供2个空的(n-1)d轨道,所以形成内轨配键;例如[Ti(H₂O)₆]³⁺中的Ti³⁺中d轨道只有1个电子,形成d²sp³杂化的内轨配合物。
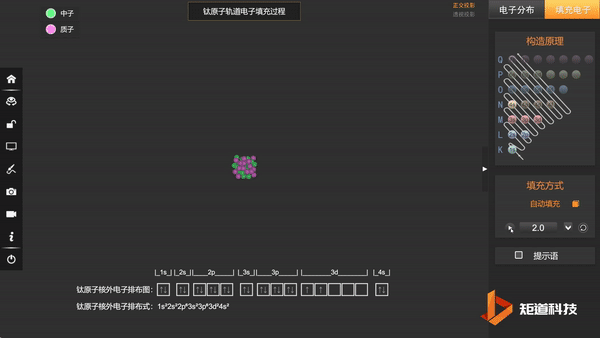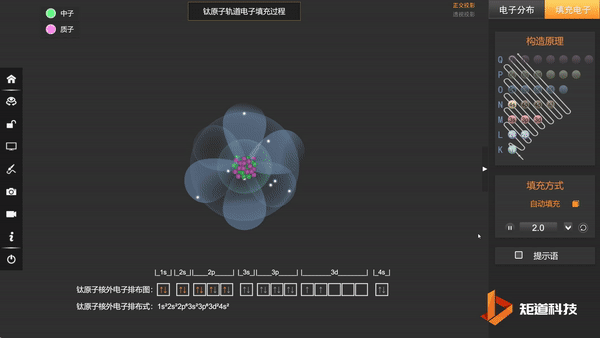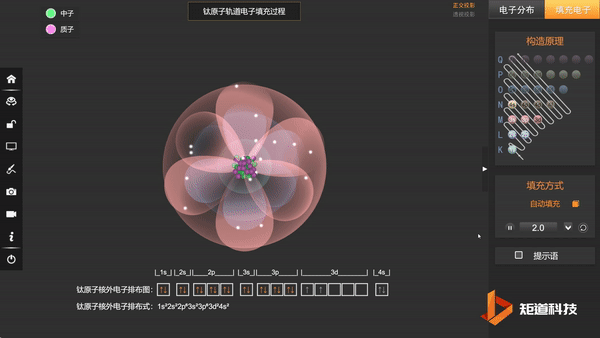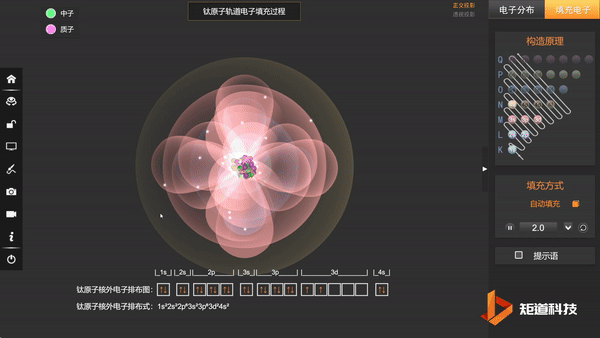
Ti原子的核外电子排布,失去三个电子后价电子为3d¹
(3)具有 d⁴~d⁸构型的离子既可形成内轨配键,也可形成外轨配键,是内轨配键还是外轨配键取决于与形成体成键的配体的性质。
例如,Ni²⁺的外层价电子构型为 3d⁸。
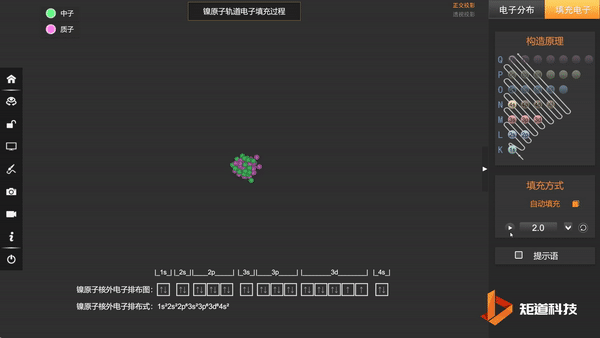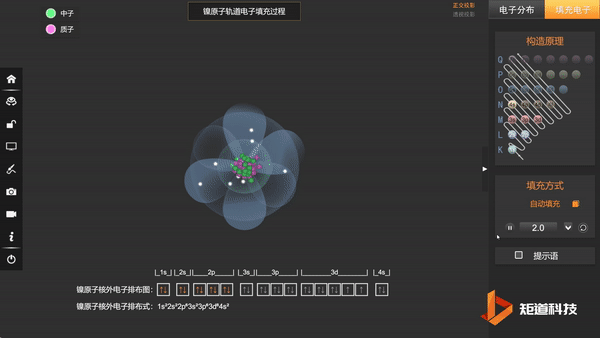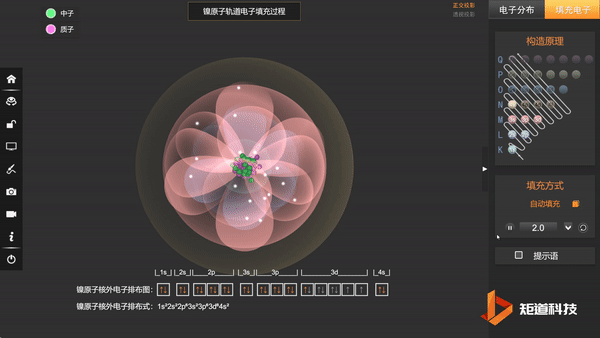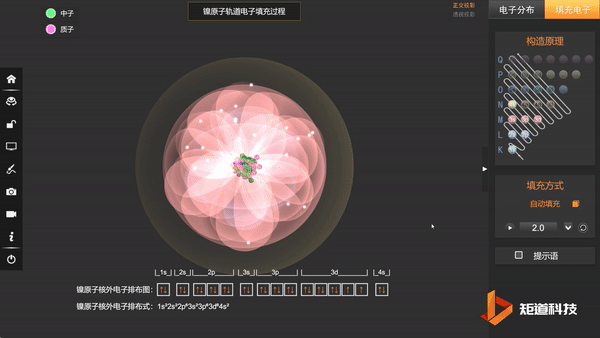
Ni原子的核外电子排布,失去两个电子后价电子为3d⁸
当与NH₃成键时,Ni²⁺外层的4s与4p轨道构成 sp³杂化轨道,形成外轨配合物[Ni(NH₃)₄]²⁺,空间构型为正四面体。
当Ni²⁺与CN⁻形成配位键时,Ni²⁺的杂化形式为 dsp²,即 3d轨道的2个单电子成对,空出1个空的3d轨道与外层的1个 4s和2个 4p轨道形成 dsp²杂化轨道,CN⁻的孤对电子填入杂化轨道中。因此[Ni(CN)₄]²⁻是内轨型配合物,空间构型是平面四边形。
02
中心离子/原子的电荷
形成体的电荷增多,对配体的电子引力增大,便于进入内层轨道,有利于形成内轨配键。例如,[Co(NH₃)₆]²⁺是外轨型配合物,[Co(NH₃)₆]³⁺是内轨型配合物。
03
配位原子的电负性
这是最为关键的影响因素。电负性大的配位原子吸引电子的能力强,通常不易提供孤对电子,往往只能与形成体的外层轨道形成外轨配键,易形成外轨配合物。
例如,CN⁻和F⁻相比,CN⁻参与配位的C原子电负性较小,F原子电负性较大,前者与Fe³⁺形成内轨型配合物,后者则形成外轨型配合物。
END
















