电化学主要是研究电能和化学能之间的互相转化以及转化过程中相关规律的科学。能量的转化需要一定的条件(即要提供一定的装置和介质)。例如,化学能转化成电能必须通过原电池 (primary cell) 来完成,电能转化成化学能则需要借助电解池 (electrolytic cell)来完成。无论是原电池还是电解池,都需要知道电极 (electrode)和相应的电解质溶液(electrolyte solution) 中所发生的变化及其机理。
电化学的发展历史可以追溯到人们对电的认识。早在1600 年,Gilbert观察到用毛皮擦过的琥珀具有吸引其他轻微物体的能力,就用“electricus”(拉丁语,即“像琥珀一样的”)来描述这种行为。

通过虚拟仿真实验观察与丝绸摩擦之后的有机玻璃棒吸引纸屑
但直到 1799 年,意大利物理学家 Volta 从银片、锌片交替的叠堆中成功地产生了可见火花,才提供了用直流电源进行广泛研究的可能性。同年,Carlisle和Nicholson用这种电堆进行水的电解,得到了氢气和氧气。1807 年,英国化学家 Davy 用电解成功地从钠、钾的氢氧化物分离出金属和钾。

点燃电解水生成的H₂
1833 年英国物理学家和化学家 Faraday 根据多次实验结果归纳出了著名的 Faraday 电解定律,为电化学的定量研究和以后的电解工业奠定了理论基础。但直到 1870 年,人们发明了发电机,电解才开始被广泛地应用于工业中。
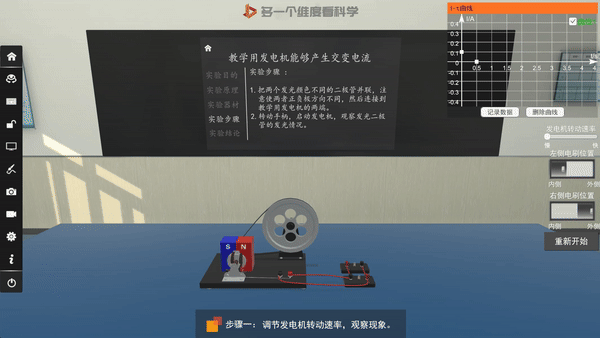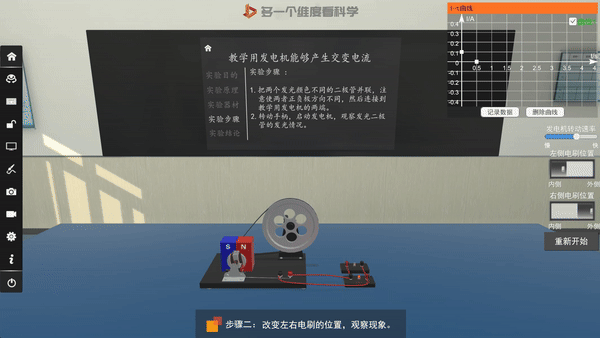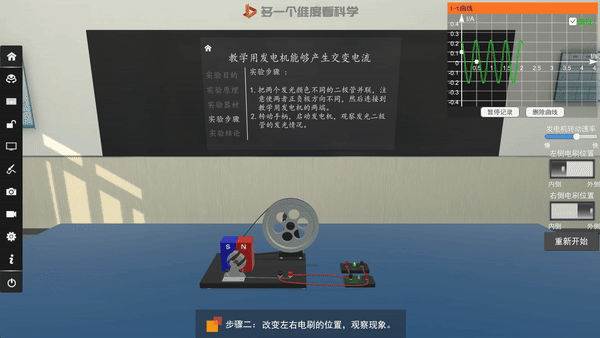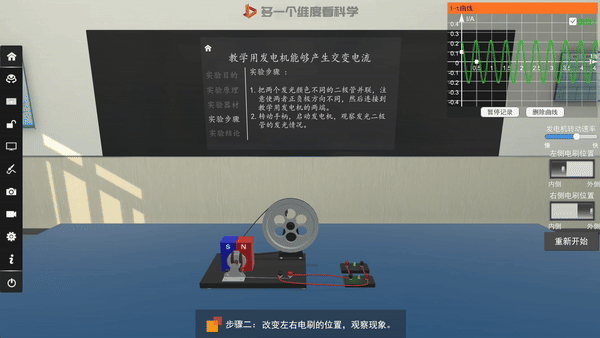
交流发电机的原理——电磁感应
1893 年德国物理学家和化学家 Nernst 根据热力学理论提出了可逆电池电动势的计算公式,即 Nernst 方程,表示电池的电动势与参与电池反应的各种物质的性质、浓度及外在条件 (温度、压力等) 的关系,为电化学平衡理论的发展做出了突出贡献。
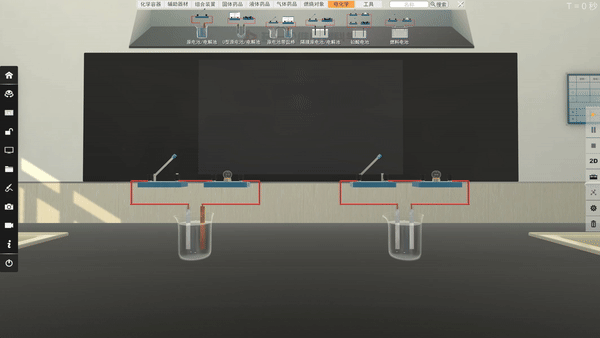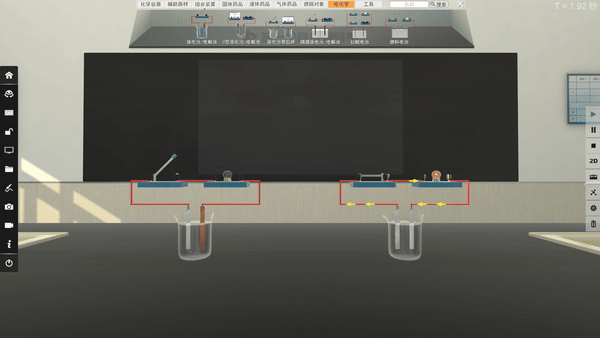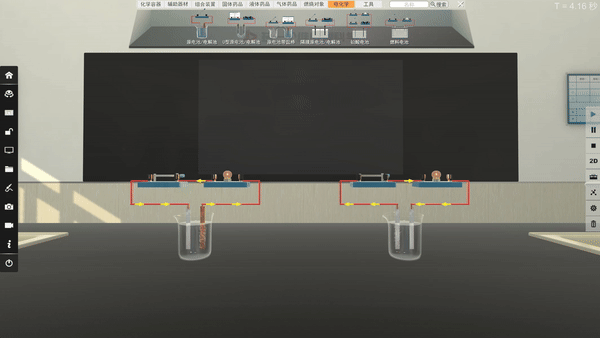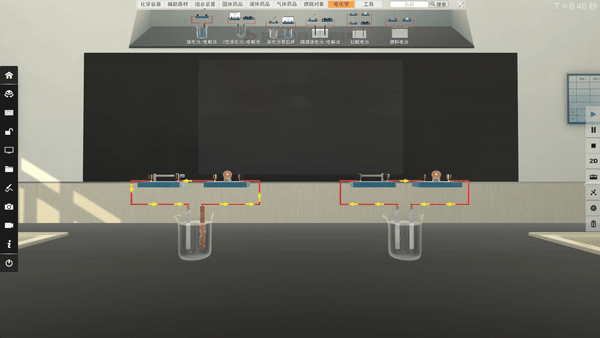
选取不同电极,电流方向改变
1923 年,Debye 与 Hückel 提出了强电解质溶液中的离子互吸理论,推动了电化学理论的进一步发展。1905 年,Tafel 开始注意到电极反应的不可逆现象,提出了半经验的 Tafel 公式,用以描述电流密度和氢超电势之间的关系。20世纪40年代,苏联学者弗鲁姆金以电极反应速率及其影响因素为主要研究对象,逐步形成了电极反应动力学。
在电极上发生氧化或还原反应时,电子的跃迁距离小于1 nm。显然,利用固体物理学的理论和量子力学的方法研究电极和溶液界面上所进行反应的机理,更能反映出问题的实质。这是研究在界面上进行的电化学反应的一个崭新的领域被称为量子电化学。
利用矩道化学融合创新实验室,全面贴合新课程标准知识点,既能满足日常实验教学,又能弥补传统实验不足,达到以虚补实的效果,生动直观地呈现微观实验原理,辅助实现高效课堂。
END
















