01
质子、中子和电子
尽管科学家已经发现了很多的亚原子粒子,但是在化学中主要关注的还是电子、质子和中子,其性质总结如下:
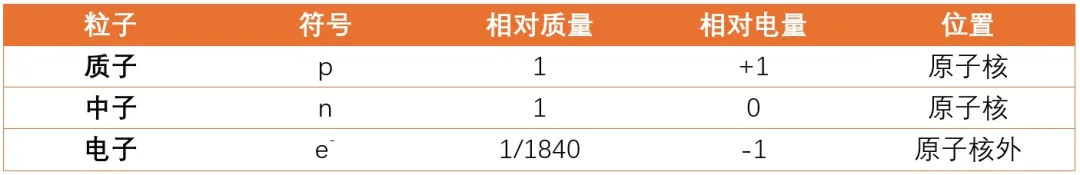
卢瑟福发现了质子,他也被认为是第一个提出原子有一个非常小的核心,其中包含了原子的大部分质量。这个核心被称为原子核,它包含了原子中所有的质子和中子。电子以围绕原子核的能级存在。
我们借助矩道化学虚拟实验室软件,观察原子的结构。

02
原子序数、质量数和同位素

上图为在虚拟仿真平台--矩道化学虚拟实验室中呈现的碳原子结构,可以用符号
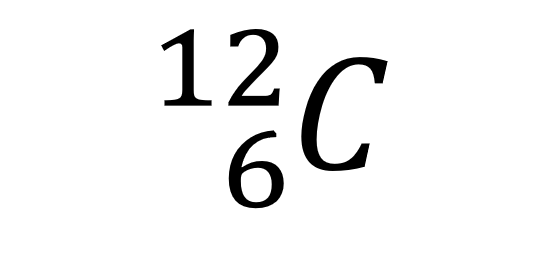
来表示,其中“6”表示原子序数,等于原子中的质子数(也等于原子中的电子数)。
“12”表示原子的质量数,等于原子中的质子数+中子数。
同位素是指一类具有相同质子数但是质量数不同的元素,比如碳-13,符号写作
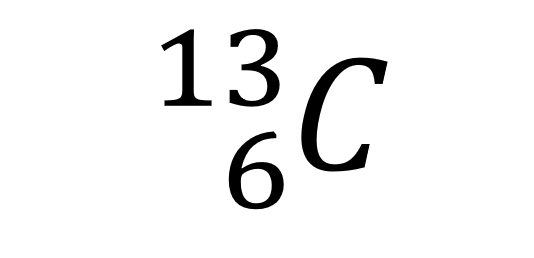
它与常见的碳原子具有相同的化学性质,但是质量数大了1,原因是多一个中子。
03
前四能层的电子
普朗克在1900年首次提出了量子理论。根据这一理论,电子只能存在于某些被称为能层的位置中。
对于该元素来说,第一个能层中的电子具有最低的能量。
第一个能层是在最靠近原子核的区域发现的。第二能层位于第一能层之外的区域,以此类推。
除了第一个能层,每个能层都被进一步划分为能量略有不同的能级中。
在第一个能层中只有一个能级。它被标记为1s。

第二个能层有两个能级,分别是2s和2p。

2p中的电子比2s中的电子具有稍高的能量。

第三个能层被分成三个能级,分别是3s、3p和3d。

3p的电子比3s的能量略高,

而3d的电子也比3p的能量略高。

第四个能层被分成四个能级,分别标记为4s、4p、4d和4f。
同样,电子能量按4s < 4p < 4d < 4f的顺序增加。
以上就是对于能层和能级的介绍,借助矩道虚拟实验室软件,能够直观呈现各能级形态结构,了解原子的结构。
END
















