01
s轨道
能级包含着轨道。如果你能看到氢原子中的单个电子,并按一定的间隔绘制出它的位置,那么你就能构造出一个三维的有可能找到电子的地方。大多数时候,电子位于靠近原子核的一个相当容易定义的空间区域内。以下,我们借助矩道化学VR实验室软件,探索原子中电子的排布。

H原子的1s轨道
因为氢原子的电子在K能层s能级,所以轨道被描述为1s轨道。
2s能级的电子也存在于s轨道中,叫做2s轨道。
2s轨道和1s轨道形状相同,但是更大。

Li原子的1s和2s轨道(比例仅供参考)
轨道的大小和形状意味着在它们的边界内找到电子的概率是90%。
02
p轨道
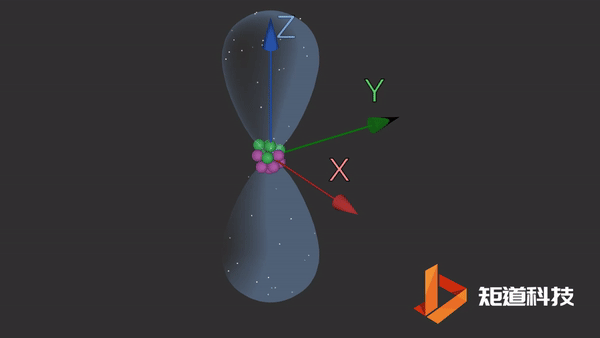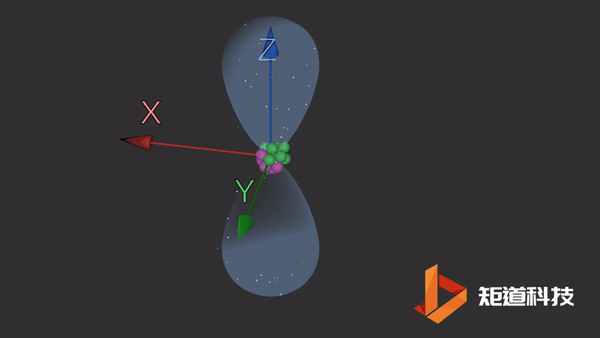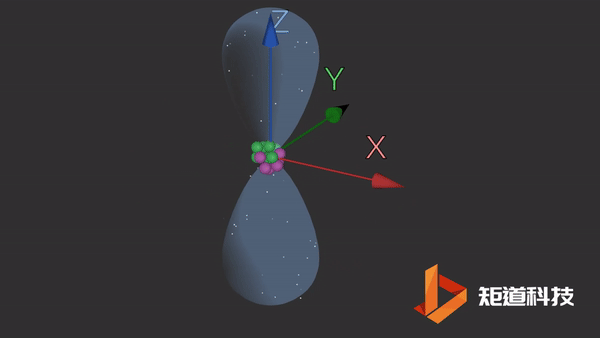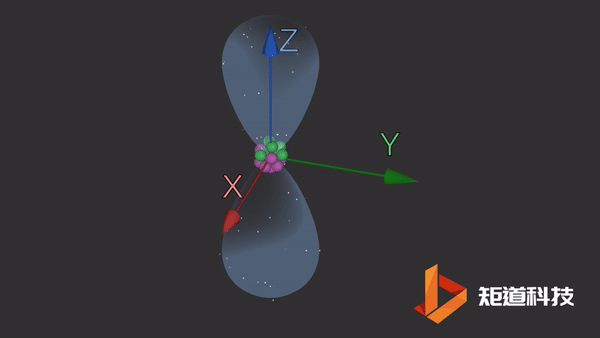
2p能级包含三个独立的p轨道。这些轨道更复杂,更难以想象。它们有一个细长的哑铃形状。这三个轨道之间唯一的区别是它们在空间中的方向。

px轨道

py轨道
pz轨道
同样,轨道的大小和形状意味着在它们的边界内找到电子的概率为90%。这三个轨道以相互的直角排列。
03
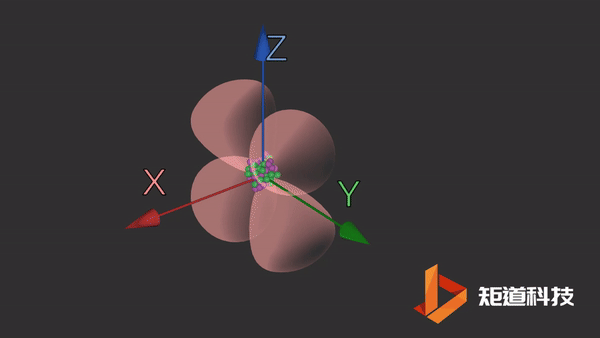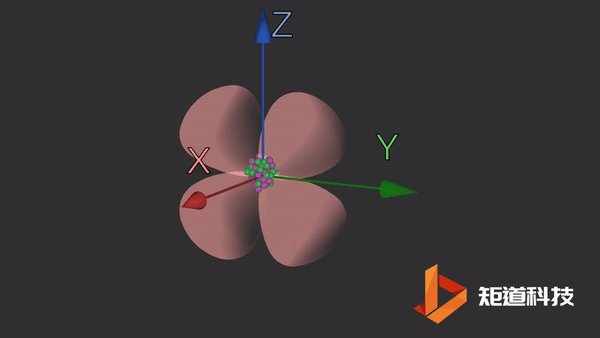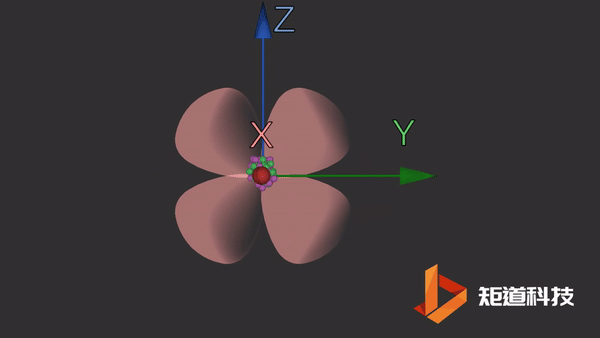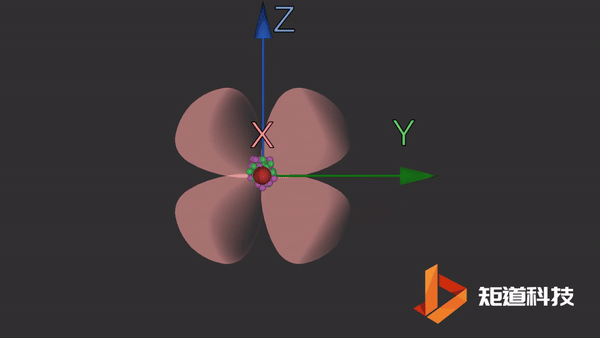
d轨道
d轨道非常复杂。在d能级中有5个d轨道。

dx2-y2轨道
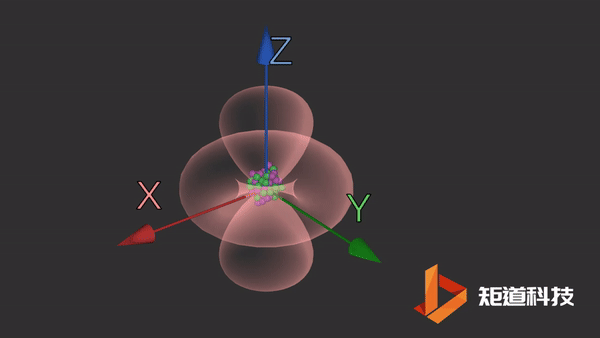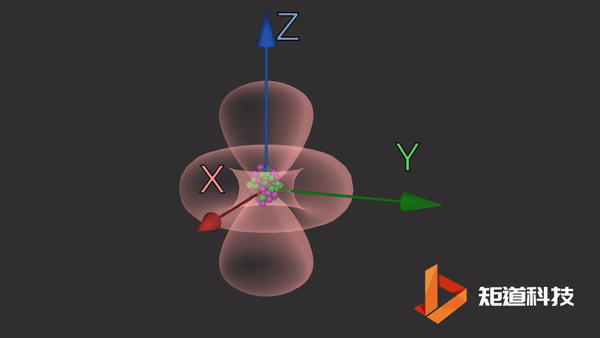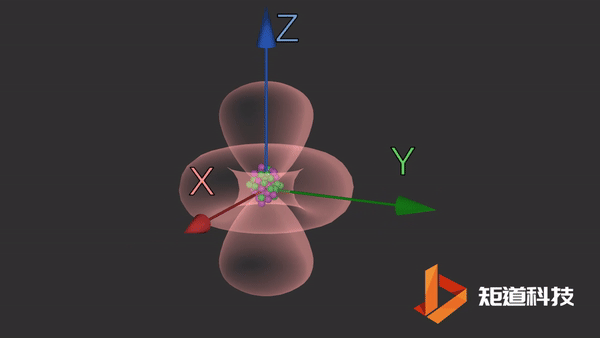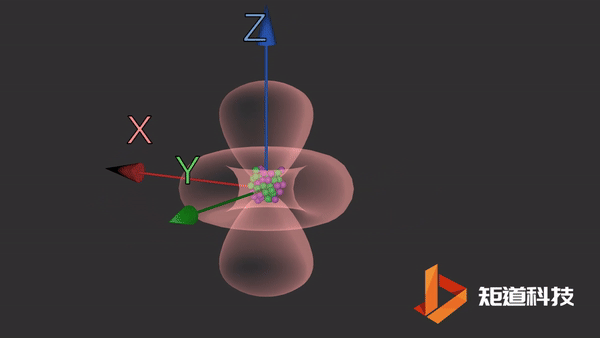
dz2轨道
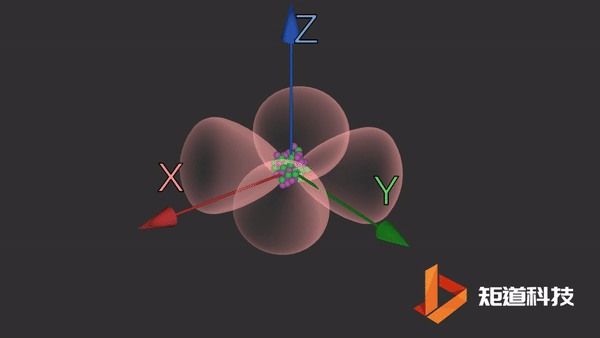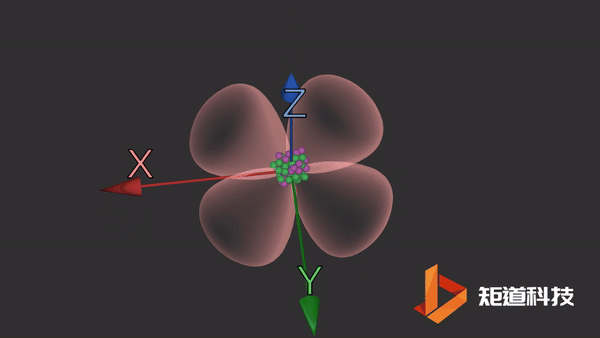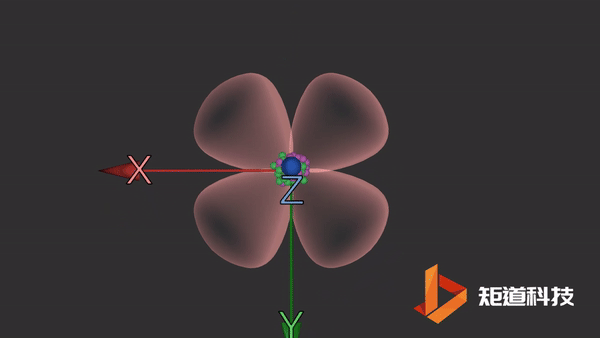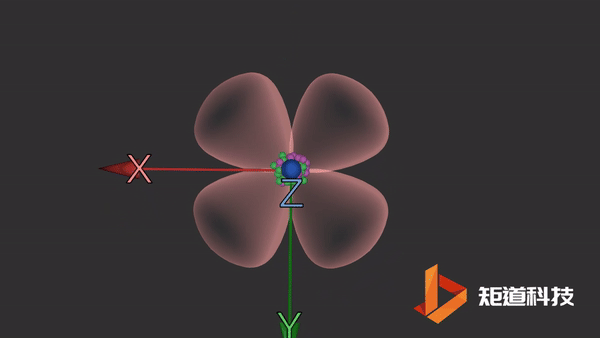
dxy轨道
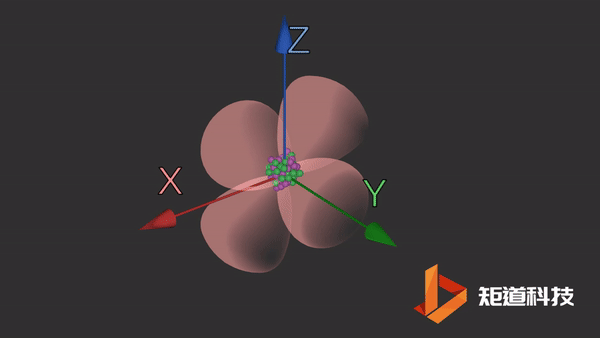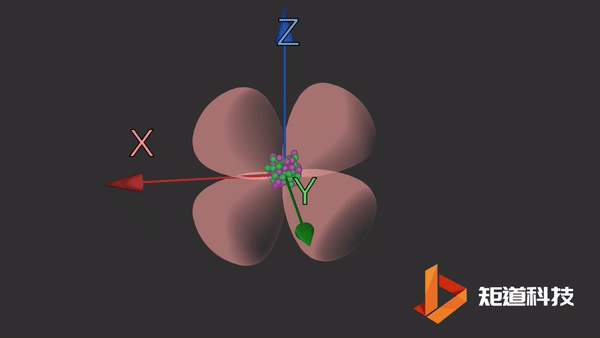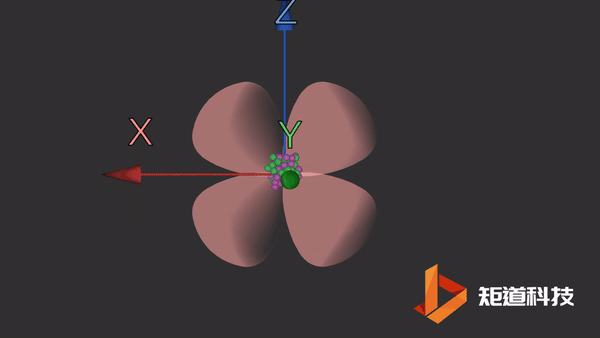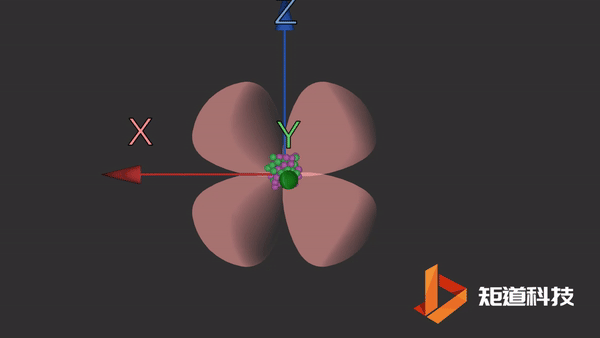
dxz轨道
dyz轨道
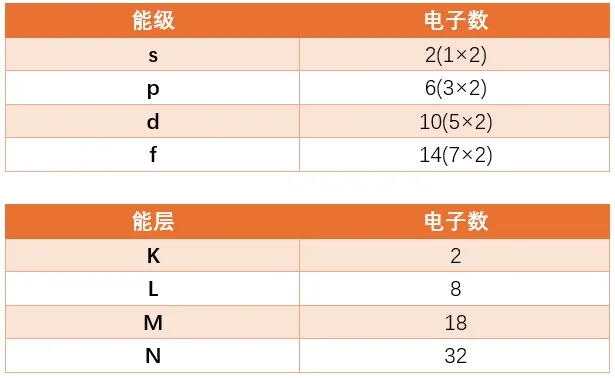
每个轨道上最多可以有两个电子。
利用这些信息,每个能级和能层中可以存在的电子数如表所示。
END
















